
| A. | 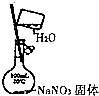 配置一定物质的量 浓度的NaNO3溶液 | |
| B. | 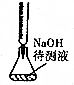 中和滴定 | |
| C. | 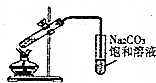 制备乙酸乙酯 | |
| D. | 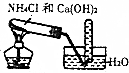 实验室制取氨 |
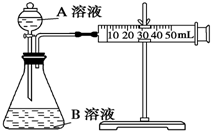
分析 A.不能在容量瓶中溶解;
B.图中为碱式滴定管;
C.乙酸与乙醇、浓硫酸发生酯化反应生成乙酸乙酯,饱和碳酸钠可吸收乙醇、除去乙酸、降低酯的溶解度,导管口在液面上可防止倒吸;
D.氨气极易溶于水.
解答 解:A.不能在容量瓶中溶解,应在烧杯中稀释、冷却后转移到容量瓶中,故A错误;
B.图中为碱式滴定管,为酸滴定碱,应选酸式滴定管,故B错误;
C.乙酸与乙醇、浓硫酸发生酯化反应生成乙酸乙酯,饱和碳酸钠可吸收乙醇、除去乙酸、降低酯的溶解度,导管口在液面上可防止倒吸,图中制备实验合理,故C正确;
D.氨气极易溶于水,不能利用排水法收集,故D错误;
故选C.
点评 本题考查化学实验方案的评价,为高频考点,把握溶液配制、中和滴定、乙酸乙酯的制备及氨气的制备等为解答的关键,侧重分析与实验能力的考查,注意实验装置的作用及实验评价性分析,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 向汽油中添加乙醇后,该混合燃料的热值不变,但可以达到减排的目的 | |
| B. | 侯氏制碱法的工艺流程应用了物质溶解度的差异 | |
| C. | 光导纤维、氧化铝陶瓷、PE、硅藻土都是无机非金属材料,橡胶、酚醛树脂都是人工合成高分子材料 | |
| D. | 泡沫灭火器是常见灭火器之一,其内筒为塑料桶,盛有碳酸氢钠溶液,外筒为金属材质,内外筒之间盛装硫酸铝溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 甲、乙两个实验小组利用KMnO4酸性溶液与H2C2O4溶液反应研究影响反应速率的因素.
甲、乙两个实验小组利用KMnO4酸性溶液与H2C2O4溶液反应研究影响反应速率的因素.| 序号 | A | B |
| 1 | 2ml0.1mol/LH2C2O4溶液 | 4ml0.01mol/LKMnO4溶液 |
| 2 | 2ml0.2mol/LH2C2O4溶液 | 4ml0.01mol/LKMnO4溶液 |
| 3 | 2ml0.2mol/LH2C2O4溶液 | 4ml0.01mol/LKMnO4溶液和少量MnSO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Q=197KJ | B. | Q<197×2 KJ | C. | Q<197KJ | D. | Q>197KJ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
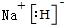 ;RX与X2Q反应的化学方程式为NaH+H2O=NaOH+H2↑.
;RX与X2Q反应的化学方程式为NaH+H2O=NaOH+H2↑.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素X与元素Y能形成离子化合物 | |
| B. | 原子序数为:X<Y<Z | |
| C. | 元素Z最高价氧化物对应水化物具有两性 | |
| D. | 元素Y形成的气态氢化物水溶液呈强酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
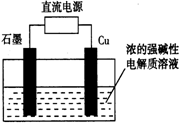 Cu2O可由电解制取,如图所示,电解总反应:2Cu+H2O=Cu2O+H2↑.下列说法正确的是( )
Cu2O可由电解制取,如图所示,电解总反应:2Cu+H2O=Cu2O+H2↑.下列说法正确的是( )| A. | 石墨电极上产生氢气 | B. | 铜电极发生还原反应 | ||
| C. | 铜电极接直流电源的负极 | D. | 该反应也可设计为原电池 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com