
 温度为t℃时,在10mL1.0mol/L的盐酸中,逐滴滴入xmol/L的氨水,随着氨水遂渐加入,溶液中的温度变化曲线(曲线I)和pH变化曲线(曲线II)如图所示(忽略混合时溶液体积的变化).下列有关判断正确的是( )
温度为t℃时,在10mL1.0mol/L的盐酸中,逐滴滴入xmol/L的氨水,随着氨水遂渐加入,溶液中的温度变化曲线(曲线I)和pH变化曲线(曲线II)如图所示(忽略混合时溶液体积的变化).下列有关判断正确的是( )| A. | c点时,c(NH3•H2O)=1.0mol•L-1 | B. | a点时,水的电离程度最大 | ||
| C. | b点时,c(NH4+)>c(Cl-)>c(H+)>c(OH-) | D. | c点时,c(NH3•H2O)=$\frac{x-1}{2}$mol•L-1 |
分析 A、c点时溶液显示中性,得到的溶液是氯化铵和氨水,据此回答;
B、根据图象可知,a点时溶液酸性最强,为盐酸,水的电离程度受到抑制;
C、根据电荷守恒:c(NH4+)+c(H+)=c(Cl-)+c(OH-)来判断;
D、25℃时溶液的pH=7,则c(H+)=c(OH-)=10-7 mol•L-1,c(NH4+)=c(Cl-)=0.5mol/L,根据物料守恒可知:c(NH3•H2O)=(0.5x-0.5)mol/L.
解答 解:A、c点时溶液显示中性,得到的溶液是氯化铵和氨水,c(NH3•H2O)<1.0mol•L-1,故A错误;
B、根据图象可知,a点时溶液酸性最强,为盐酸,水的电离程度受到抑制,水的电离程度最小,故B错误;
C、b点时溶液的pH<7,则c(H+)>c(OH-),根据电荷守恒可知:c(Cl-)>c(NH4+),溶液中正确的离子浓度大小为:c(Cl-)>c(NH4+)>c(H+)>c(OH-),故C错误;
D、根据图象可知,25℃时溶液的pH=7,则:c(H+)=c(OH-)=10-7 mol•L-1,c(NH4+)=c(Cl-)=0.5mol/L,根据物料守恒可知:c(NH3•H2O)=(0.5x-0.5)mol/L=$\frac{x-1}{2}$mol/L,故D正确.
故选D.
点评 本题考查了酸碱混合的定性判断及离子浓度大小比较,题目难度中等,涉及水的电离及其影响、酸碱混合的定性判断及溶液pH的计算、离子浓度大小比较、水解平衡常数的计算等知识,D为难点,注意掌握水解平衡常数的表达式及计算方法.


 互动英语系列答案
互动英语系列答案科目:高中化学 来源: 题型:选择题
| A. | 在同温同压时,相同体积的任何气体单质所含的原子数目相同 | |
| B. | 常温常压下,32 g氧气(O2)和32 g臭氧(O3)都含有2NA个氧原子 | |
| C. | 500 mL 0.2 mol/L Na2SO4溶液中含有NA个Na+离子 | |
| D. | 在标准状况下,22.4L水的质量约为18g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
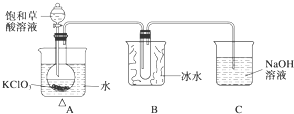 某研究性学习小组组装了下图所示的装置制备ClO2气体(加热装置用“△”表示),反应原理为饱和草酸溶液与KClO3粉末在60℃时反应制得ClO2(温度过高或过低都会影响制气效率).
某研究性学习小组组装了下图所示的装置制备ClO2气体(加热装置用“△”表示),反应原理为饱和草酸溶液与KClO3粉末在60℃时反应制得ClO2(温度过高或过低都会影响制气效率).| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量沉淀于试管中,加入足量0.1 mol•L-1 HCl. | |
| 步骤2:往步骤1的剩余物中,再滴加几滴0.01 mol•L-1 KMnO4. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 用如图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是( )
用如图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是( )| 选项 | ①中物质 | ②中物质 | 预测②中的现象 |
| A | 稀盐酸 | 碳酸钠与氢氧化钠的混合溶液 | 立即产生气泡 |
| B | 浓硝酸 | 用砂纸打磨过的铝条 | 产生大量红棕色气体 |
| C | 氯化铝溶液 | 浓氢氧化钠溶液 | 立即产生大量白色沉淀 |
| D | 氨水 | 硝酸银溶液 | 先产生白色沉淀后沉淀逐渐溶解 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol | B. | 15mol | C. | 22mol | D. | 5mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图所示,①和②为两个体积相同的固定容器,图中“○”和“●”分别表示氢原子和氧原子,则下列说法正确的是( )
如图所示,①和②为两个体积相同的固定容器,图中“○”和“●”分别表示氢原子和氧原子,则下列说法正确的是( )| A. | 若①中的H2为1 mol,则②中所含原子总数为3.01×1023个 | |
| B. | ①和②中气体的质量之比为1:8 | |
| C. | H2、O2均能发生化合反应,但不能发生置换反应 | |
| D. | 两容器的温度和压强均相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | +3 | B. | +4 | C. | +5 | D. | +6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用10ml量筒量取7.13ml稀盐酸 | |
| B. | 用托盘天平称量25.20g NaCl | |
| C. | 用广泛pH试纸测得某溶液的pH为2.3 | |
| D. | 中和滴定时用去某浓度的碱溶液21.70mL |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com