
【题目】氯乙烯是一种重要的有机化工原料,某化学小组利用如图装置制备氯乙烯,下列有关说法错误的是
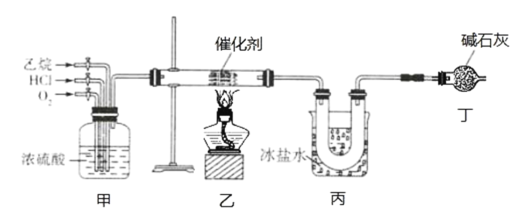
A.装置乙中发生反应的化学方程式为:CH3CH3+HCl+O2![]() CH2=CHCl+2H2O
CH2=CHCl+2H2O
B.装置甲可通过控制通入气体的速率来控制反应气体的物质的量之比
C.装置丙的主要作用为冷凝并分离出氯乙烯
D.装置丁可以完全吸收尾气,实现尾气零排放
【答案】D
【解析】
装置甲干燥气体并通过控制通入气体的速率来控制反应气体的物质的量之比,在乙发生反应,反应方程式为:CH3CH3+HCl+O2![]() CH2=CHCl+2H2O,反应物不可能全部反应完,因此在丙处是混合物,丙处冷凝得到氯乙烯液体,CH3CH3、HCl、O2三种气体通入丁处,起干燥和吸收HCl的作用,得到CH3CH3、O2两种未反应完的气体。
CH2=CHCl+2H2O,反应物不可能全部反应完,因此在丙处是混合物,丙处冷凝得到氯乙烯液体,CH3CH3、HCl、O2三种气体通入丁处,起干燥和吸收HCl的作用,得到CH3CH3、O2两种未反应完的气体。
A. 根据题意可知,乙烷、HCl、O2在催化剂条件下制备氯乙烯,因此装置乙中发生反应的化学方程式为:CH3CH3+HCl+O2![]() CH2=CHCl+2H2O,故A正确;
CH2=CHCl+2H2O,故A正确;
B. 装置甲起干燥作用及可通过控制通入气体的速率来控制反应气体的物质的量之比,故B正确;
C. 装置丙的主要作用为冷凝并分离出氯乙烯液体,混合气体进入到丁处,故C正确;
D. 装置丁碱石灰只能吸收尾气中的HCl气体,而未反应完的CH3CH3不能被吸收,故D错误。
综上所述,答案为D。


科目:高中化学 来源: 题型:
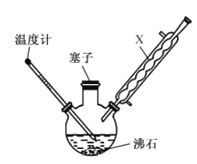
【题目】某同学在实验室以苯胺(密度:1.02g.mL—1)和浓硫酸为原料制备对氨基苯磺酸(![]() ),反应原理以及反应装置(加热及夹持仪器已省略)如下:
),反应原理以及反应装置(加热及夹持仪器已省略)如下:
![]() +H2SO4(浓)
+H2SO4(浓)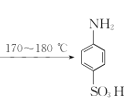 +H2O
+H2O
已知:100mL水在20C时可溶解对氨基苯磺酸1.08g,在100C时可溶解6.67g 。实验步骤:
I.在100mL三颈烧瓶中加入10mL苯胺及几粒沸石,将三颈烧瓶放入冷水中冷却,小心地加入20mL浓硫酸;
II.将三颈烧瓶置于加热装置中缓慢加热至170~180℃,维持此温度2~2.5h;
III.将反应液冷却至约50℃后,倒入盛有100mL冷水的烧杯中,用玻璃棒不断搅拌,促使晶体析出,抽滤,用少量冷水洗涤,得到对氨基苯磺酸粗产品;
VI.将粗产品用沸水溶解,冷却结晶,抽滤,收集产品,晾干得到16.2g对氨基苯磺酸。
回答下列问题:
(1)装置中,x的名称为______________ ,其作用是__________________ 。
(2)步骤II中,“加热装置”是 ________ (填“油浴”或“水浴”)装置。
(3)步骤III中,需用少量冷水洗涤对氨基苯磺酸粗产品的原因是________________ 。
(4)步骤VI,冷却结晶过程中,若溶液颜色过深,可用__________(填一种吸附剂)脱色。
(5)本实验中对氨基苯磺酸的产率为__________(结果保留两位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42-可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室。下列叙述正确的是

A. 通电后中间隔室的SO42-离子向正极迁移,正极区溶液pH增大
B. 该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品
C. 负极反应为2H2O–4e–=O2+4H+,负极区溶液pH降低
D. 当电路中通过1mol电子的电量时,会有0.5mol的O2生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钨广泛用于冶金、机械、建筑、电子等领域。以黑钨精矿为原料冶炼钨的流程如图所示:
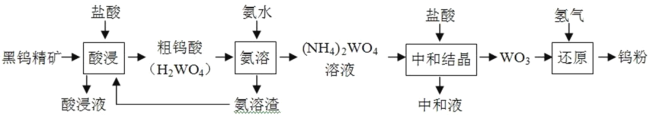
请回答下列问题。
(1)“酸浸液”中含有 Fe3+、Fe2+等金属离子,检验其中的 Fe2+常使用铁氰化钾溶液,反应的离子方程式 为_____。
(2)“氨溶”时需加热,但应控制温度不超过 70℃的原因为_____。
(3)“中和结晶”时(NH4)2WO4 与盐酸反应生成 WO3 的化学方程式为_____,所得“中和 液”的主要溶质的电子式为_____。
(4)流程图中设计将“氨溶渣”返回“酸浸”过程的目的为__________。
(5)钨钛合金在工业中应用广泛, NH4Fe(SO4)2 滴定法可测定合金中钛的含量:称取 w g 钨钛合金,用 HNO3-HF混合液溶解,用 NaOH 溶液沉淀并分离钛元素后加盐酸溶解,用金属铝将 Ti4+还原为 Ti3+,向溶液中加几滴 KSCN 作指示剂,用 c mol/L 的 NH4Fe(SO4)2 标准溶液滴定至溶液显红色,消耗标准溶液的体积为 V mL。
①滴定时发生反应的离子方程式是_____;
②样品中钛的含量为_____%(用含 w、c、V 的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生的实验报告中,描述合理的是( )
A.用量筒量取25.20mL的稀盐酸
B.用pH试纸测得NaClO溶液的pH约为11
C.将CuCl2溶液蒸发浓缩、降温结晶、过滤得到氯化铜晶体
D.用25mL酸式滴定管量取出15.00mLKMnO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20.00mL0.1mol·L-1氨水中滴入0.1mol·L-1盐酸,溶液中由水电离出的c(H+)的负对数[-1gc水(H+)]与所加盐酸体积的关系如图所示,下列说法不正确的是( )
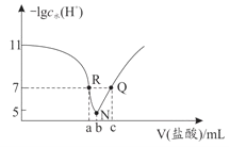
A.常温下,Kb(NH3·H2O)约为1×10-5
B.b=20.00
C.R、Q两点对应溶液均呈中性
D.R到N、N到Q所加盐酸体积不相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用铅蓄电池进行电絮凝净水是水净化方面的一项研究课题,其工作原理如图所示,下列叙述正确的是( )

A.Y的电极反应:PbO2+2e-+SO42-+4H+=PbSO4+2H2O
B.铅蓄电池工作时H+向X极移动
C.电解池的总反应本质为电解水
D.每消耗103.5gPb,理论上电解池阴极上有11.2LH2生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸及其盐是重要的化工原料,其中最常用的是三草酸合铁酸钾和草酸钴,已知草酸钴不溶于水,三草酸合铁酸钾晶体(![]() )易溶于水,难溶于乙醇。这两种草酸盐受热均可发生分解等反应,反应及气体产物检验装置如图。
)易溶于水,难溶于乙醇。这两种草酸盐受热均可发生分解等反应,反应及气体产物检验装置如图。
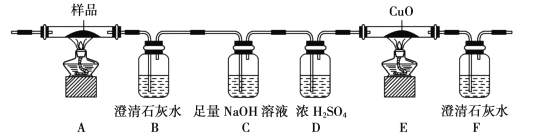
(l)草酸钴晶体(![]() )在200℃左右可完全失去结晶水。用以上装置在空气中加热5. 49 g草酸钴晶体(
)在200℃左右可完全失去结晶水。用以上装置在空气中加热5. 49 g草酸钴晶体(![]() )样品,受热过程中不同温度范围内分别得到一种固体物质,其质量如下表。
)样品,受热过程中不同温度范围内分别得到一种固体物质,其质量如下表。
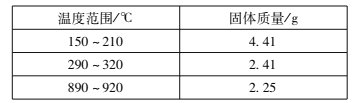
实验过程中观察到只有B中澄清石灰水明显变浑浊,E中始终没有红色固体生成。根据实验结果,290 - 320℃过程中发生反应的化学方程式是____;设置D的作用是____。
(2)用以上装置加热三草酸合铁酸钾晶体可发生分解反应。
①检查装置气密性后,先通一段时间的N2,其目的是 ___;结束实验时,先熄灭酒精灯再通入N2至常温。实验过程中观察到B、F中澄清石灰水都变浑浊,E中有红色固体生成,则分解得到的气体产物是____。
②C的作用是是____。
(3)三草酸合铁酸钾的一种制备流程如下:
![]()
回答下列问题:
①流程“I”硫酸必须过量的原因是 ____
②流程中“Ⅲ”需控制溶液温度不高于40℃,理由是____;得到溶液后,加入乙醇,然后进行过滤。加入乙醇的理由是____
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com