
·ÖĪö £Ø1£©CH4ŌŚøßĪĀ”¢“߻ƼĮ×÷ÓĆĻĀÓėĖ®ÕōĘų·“Ó¦µÄ·½³ĢŹ½ĪŖCH4£Øg£©+2H2O£Øg£©=CO2£Øg£©+4H2£Øg£©£¬Éś³É2mol CO2ĪüŹÕ316kJČČĮ棬Ōņ1molCH4Čž¼Ó·“Ó¦Ź±ŠčŅŖĪüŹÕµÄČČĮæĪŖ158kJ£¬CO2ÓėK2CO3ČÜŅŗ·“Ӧɜ³ÉĢ¼ĖįĒāÄĘ¼Ų£¬¾Ż“Ė“šĢā£»
£Ø2£©¢ŁÕż·“Ó¦ŹĒ·ÅČČ·“Ó¦£¬ÉżøßĪĀ¶ČĘ½ŗāÄęĻņŅĘ¶Æ£¬°±ĘųµÄŗ¬Įæ¼õŠ”£»
¢ŚA£®KÖ»ŹÜĪĀ¶ČÓ°Ļģ£¬ĪĀ¶Č²»±äĘ½ŗā³£Źż²»±ä£¬Õż·“Ó¦ĪŖ·ÅČČ·“Ó¦£¬ÉżøßĪĀ¶ČĘ½ŗāÄęĻņŅĘ¶Æ£¬Ę½ŗā³£Źż¼õŠ”£»
B£®¼Ó“߻ƼĮÄܼÓæģ·“Ó¦ĖŁĀŹµ«Ę½ŗā²»ŅĘ¶Æ£»
C£®ĻąĶ¬Ń¹ĒæĻĀ£¬Ķ¶ĮĻĻąĶ¬£¬ĪĀ¶ČŌ½øß·“Ó¦ĖŁĀŹŌ½æģ£¬“ļµ½Ę½ŗāĻūŗÄŹ±¼äŌ½¶Ģ£»
D£®øĆ·“Ó¦ĪŖæÉÄę·“Ó¦£¬·“Ó¦µÄ×Ŗ»ÆĀŹ²»æÉÄÜ“ļµ½100%£»
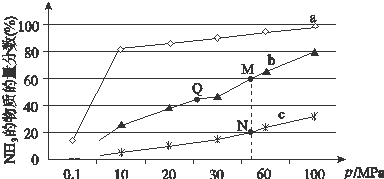
¢Ūøł¾Ż·“Ó¦N2£Øg£©+3H2£Øg£©?2NH3£Øg£©ĄūÓĆČż¶ĪŹ½¼ĘĖć³öĘ½ŗāŹ±ø÷ĪļÖŹµÄÅØ¶Č£¬²¢¼ĘĖćĘ½ŗā³£Źż£»
£Ø3£©Éś³ÉµÄĪŽĪŪČ¾µÄĪļÖŹĪŖµŖĘų£¬øł¾Żµē½āŌĄķŠ“³öŃō¼«µē¼«·“Ó¦Ź½£»
£Ø4£©·“Ó¦6NO2+8NH3$?_{¼ÓČČ}^{“߻ƼĮ}$7N2+12H2O·½³ĢŹ½æÉÖŖ8NH3”«”«24mole-£¬ŅŌ“ĖĄ“½ā“š£®
½ā“š ½ā£ŗ£Ø1£©CH4ŌŚøßĪĀ”¢“߻ƼĮ×÷ÓĆĻĀÓėĖ®ÕōĘų·“Ó¦µÄ·½³ĢŹ½ĪŖCH4£Øg£©+2H2O£Øg£©=CO2£Øg£©+4H2£Øg£©£¬Éś³É2mol CO2ĪüŹÕ316kJČČĮ棬Ōņ1molCH4Čž¼Ó·“Ó¦Ź±ŠčŅŖĪüŹÕµÄČČĮæĪŖ158kJ£¬ĖłŅŌ·“Ó¦µÄČČ»Æѧ·½³ĢŹ½ŹĒCH4£Øg£©+2H2O£Øg£©=CO2£Øg£©+4H2£Øg£©”÷H=+158kJ/mol£¬CO2ÓėK2CO3ČÜŅŗ·“Ӧɜ³ÉĢ¼ĖįĒāÄĘ¼Ų£¬·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖCO32-+CO2+H2O=2HCO3-£¬
¹Ź“š°øĪŖ£ŗCH4£Øg£©+2H2O£Øg£©=CO2£Øg£©+4H2£Øg£©”÷H=+158kJ/mol£»CO32-+CO2+H2O=2HCO3-£»
£Ø2£©¢ŁŗĻ³É°±µÄ·“Ó¦ĪŖ·ÅČČ·“Ó¦£¬·“Ó¦ĪĀ¶ČŌ½øߣ¬Ō½²»ĄūÓŚ·“Ó¦ÕżĻņ½ųŠŠ£¬ĒśĻßaµÄ°±ĘųµÄĪļÖŹµÄĮæ·ÖŹż×īøߣ¬Ęä·“Ó¦ĪĀ¶Č¶ŌÓ¦Ļą¶Ō×īµĶ£¬ĖłŅŌaĒśĻ߶ŌÓ¦ĪĀ¶ČĪŖ200”ćC£»
¹Ź“š°øĪŖ£ŗ200”ę£»
¢ŚA£®KÖ»ŹÜĪĀ¶ČÓ°Ļģ£¬ĪĀ¶Č²»±äĘ½ŗā³£Źż²»±ä£¬ĖłŅŌK£ØM£©=K£ØQ£©£¬Õż·“Ó¦ĪŖ·ÅČČ·“Ó¦£¬ÉżøßĪĀ¶ČĘ½ŗāÄęĻņŅĘ¶Æ£¬Ę½ŗā³£Źż¼õŠ”£¬QµćµÄĪĀ¶ČµĶÓŚN£¬ĖłŅŌK£ØQ£©£¾K£ØN£©£¬¹ŹAÕżČ·£»
B£®¼Ó“߻ƼĮÄܼÓæģ·“Ó¦ĖŁĀŹµ«Ę½ŗā²»ŅĘ¶Æ£¬ĖłŅŌH2µÄĘ½ŗā×Ŗ»ÆĀŹ²»±ä£¬¹ŹBÕżČ·£»
C£®ĻąĶ¬Ń¹ĒæĻĀ£¬Ķ¶ĮĻĻąĶ¬£¬ĪĀ¶ČŌ½øß·“Ó¦ĖŁĀŹŌ½æģ£¬“ļµ½Ę½ŗāĻūŗÄŹ±¼äŌ½¶Ģ£¬cbaµÄĪĀ¶ČŅĄ“Ī½µµĶ£¬ĖłŅŌ“ļµ½Ę½ŗāĻūŗÄŹ±¼ä¹ŲĻµĪŖa£¾b£¾c£¬¹ŹC“ķĪó£»
D£®øĆ·“Ó¦ĪŖæÉÄę·“Ó¦£¬·“Ó¦µÄ×Ŗ»ÆĀŹ²»æÉÄÜ“ļµ½100%£¬¹ŹD“ķĪó£¬
¹ŹŃ”£ŗAB£»
¢ŪNµćŹ±°±µÄĪļÖŹµÄĮæµÄ·ÖŹżĪŖ20%£¬ĄūÓĆČż¶ĪŹ½£¬ÉčN2×Ŗ»ÆĀŹŹĒb£¬N2µÄĘšŹ¼ÅضČĪŖa£¬
øł¾Ż·“Ó¦N2£Øg£©+3H2£Øg£©?2NH3£Øg£©
ĘšŹ¼ a 3a 0
×Ŗ»Æ ab 3ab 2ab
Ę½ŗā a-ab 3a-3ab 2ab
øł¾ŻĢāŅāÓŠ$\left\{\begin{array}{l}{\frac{2ab}{a-ab+3a-3ab+2ab}=20%}\\{2ab=0.2mol•L{\;}^{-1}}\end{array}\right.$£¬ĖłŅŌa=0.3mol•L-1£¬b=$\frac{1}{3}$£¬ĖłŅŌĘ½ŗā³£ŹżK=$\frac{£Ø2ab£©{\;}^{2}}{£Øa-ab£©•£Ø3a-3ab£©^{3}}$=$\frac{25}{27}$£¬
¹Ź“š°øĪŖ£ŗ$\frac{25}{27}$£»
£Ø3£©ĄūÓƵē½ā·Ø½«NH3•H2O×Ŗ»ÆĪŖ¶Ō»·¾³ĪŽĪŪČ¾µÄĪļÖŹĪŖµŖĘų£¬Ńō¼«Ź§Č„µē×Ó·¢ÉśŃõ»Æ·“Ó¦£¬µē¼«·“Ó¦Ź½ĪŖ£ŗ2NH3-6e-+6OH-=N2+6H2O£¬
¹Ź“š°øĪŖ£ŗ2NH3-6e-+6OH-=N2+6H2O£»
£Ø4£©·“Ó¦6NO2+8NH3$?_{¼ÓČČ}^{“߻ƼĮ}$7N2+12H2O·½³ĢŹ½æÉÖŖ8NH3”«”«24mole-£¬ĖłŅŌĻūŗĵÄNH3ŌŚ±ź×¼×“æöĻĀµÄĢå»żŹĒ$\frac{0.6}{24}$”Į8”Į22.4L=4.48L£¬
¹Ź“š°øĪŖ£ŗ4.48£®
µćĘĄ ±¾Ģāæ¼²éĮĖČČ»Æѧ·½³ĢŹ½µÄŹéŠ“”¢»ÆŃ§Ę½ŗāµÄ¼ĘĖć”¢µē½ā³ŲŌĄķ”¢Ńõ»Æ»¹Ō·“Ó¦µÄ¼ĘĖćµČ£¬ĢāÄæÄѶČÖŠµČ£¬×¢ŅāĄūÓĆČż¶ĪŹ½½ųŠŠ»ÆŃ§Ę½ŗāµÄ¼ĘĖć£¬Ć÷Č··“Ó¦ĖŁĀŹµÄøÅÄī¼°¼ĘĖć·½·Ø£¬ŹŌĢāÅąŃųĮĖѧɜµÄ·ÖĪö”¢Ąķ½āÄÜĮ¦¼°»Æѧ¼ĘĖćÄÜĮ¦£®


 ³¬ÄÜѧµäÓ¦ÓĆĢāĢāæØĻµĮŠ“š°ø
³¬ÄÜѧµäÓ¦ÓĆĢāĢāæØĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | Ąė×Ó°ė¾¶Óɓ󵽊”£ŗZ2-£¾X+£¾Y3+£¾W2- | |
| B£® | ĘųĢ¬Ēā»ÆĪļµÄĪČ¶ØŠŌ£ŗH2WĒæÓŚH2Z | |
| C£® | ¹¤ŅµÉĻ³£²ÉÓƵē½ā·ØŅ±Į¶Y µ„ÖŹ | |
| D£® | W”¢X ŠĪ³ÉµÄ»ÆŗĻĪļÖŠŅõ”¢ŃōĄė×ÓøöŹż±ČŅ»¶ØŹĒ1£ŗ2 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® |  | B£® |  | C£® |  | D£® | 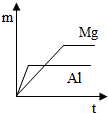 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ĒāŃõČ¼ĮĻµē³ŲµÄÕż¼«·“Ó¦Ź½ĪŖH2+2OH--2e-ØT2H2O | |
| B£® | ÓĆ²¬µē¼«µē½āĮņĖįĶČÜŅŗµÄŃō¼«·“Ó¦Ź½ĪŖ4OH--4e-ØTO2”ü+2H2O | |
| C£® | ±ķŹ¾“×ĖįÓėNaOHµÄĻ”ČÜŅŗ·“Ó¦µÄÖŠŗĶČȵĻÆѧ·½³ĢŹ½ĪŖH+£Øaq£©+OH-£Øaq£©ØTH2O£Øl£©”÷H=-57.3kJ£®mol-1 | |
| D£® | NaHSO3ČÜÓŚĖ®Ź±Ė®½āµÄĄė×Ó·½³ĢŹ½ĪŖHSO3-+H2O?SO32-+H3O+ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 0.5 mol•L-1 | B£® | 0.4 mol•L-1 | C£® | 0.3 mol•L-1 | D£® | 0.2 mol•L-1 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | Na | B£® | FeCl3 | C£® | Al | D£® | Cu |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | C2H5BrŗĶNaOHČÜŅŗ»ģŗĻ¹²ČČ | |
| B£® | ŅŅ“¼ŗĶNaOHČÜŅŗ»ģŗĻ¹²ČČ | |
| C£® | Ņ»ä嶔ĶéÓėµÄNaOHµÄ¶”“¼ČÜŅŗ»ģŗĻ¹²ČČ | |
| D£® | Āȱ½ÓėNaOHČÜŅŗ»ģŗĻ¹²ČČ |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com