
����Ŀ���ϳ��뿪��������Ȼ�粢�����ڵ������ʡ��²��ϣ���Ϊ����������ִ���ѧ����Ҫ����������ѧ֪ʶ�ش��������⣺
(1)ɳ̲��ɳ������Ҫ�ɷ���____����ҵ�Ͽ���ɳ������Ҫ�ɷ��봿���ڸ����·�Ӧ�Ʊ�Na2SiO3���÷�Ӧ�Ļ�ѧ����ʽΪ____��
(2)��������ˮ��ɱ����������������ˮ�е�����ɫʯ����Һ��������___��������˵����ˮ�к���_______(�ѧʽ�����ӷ���)��
(3)ֱ����������Ư�������Ա��棬Ч�������롣���������ʵ�顢�Ľ���Ŀǰ���õ���Ư�ۡ���ҵ��ȡƯ�۵Ļ�ѧ����ʽΪ__��
���𰸡�SiO2 SiO2 + Na2CO3 ![]() Na2SiO3 + CO2�� �ȱ�����ɫ H+��ClO-��HClO��HCl 2Cl2+2Ca(OH)2 =CaCl2 + Ca(ClO)2 + 2H2O
Na2SiO3 + CO2�� �ȱ�����ɫ H+��ClO-��HClO��HCl 2Cl2+2Ca(OH)2 =CaCl2 + Ca(ClO)2 + 2H2O
��������
����SiO2�����ʼ������ι�ҵ���⣻����������ˮ��Ӧ�IJ��������ˮ�ijɷּ����ʣ�����������Ӧ��ԭ��������
(1)ɳ̲��ɳ������Ҫ�ɷ���SiO2��SiO2�봿���ڸ����·�Ӧ�Ʊ�Na2SiO3��������Ӧ�Ļ�ѧ����ʽΪSiO2 + Na2CO3![]() Na2SiO3 + CO2����
Na2SiO3 + CO2����
(2)��������ˮ����ˮ��Ӧ����HCl��HClO������HClO��ǿ����������������ˮ�е�����ɫʯ����Һ���������ȱ�����ɫ��������˵����ˮ�к���H+��ClO-��HClO��HCl��
(3)��ҵ������Cl2����ʯ�һ����ȡƯ�۵Ļ�ѧ����ʽΪ2Cl2+2Ca(OH)2 =CaCl2 + Ca(ClO)2 + 2H2O��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͬ�¡�ͬѹ�£��������NH3��CH4�������壬�����й�˵��������ǣ���
A.����������Ŀ��ͬB.����֮��Ϊ16��17
C.������ԭ�����ʵ���֮��Ϊ3��4D.�ܶ�֮��Ϊ17��16
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������4 mol HNO3��1 mol H2SO4�Ļ����Һ��������������������Һ�н���������a��b���������۵����ʵ����Ĺ�ϵ��ͼ��ʾ(��֪ϡ����Ļ�ԭ����ֻ��NO)��
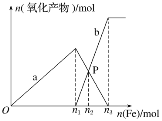
(1)b��ʾ�Ĺ�ϵ����_______(�����ӷ���)
(2)n1��______
(3)P��ʱ��n(Fe2��)��______mol
(4)��P����Һ�м���ͭ�ۣ������ܽ�________g
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
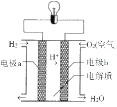
����Ŀ��ij��ѧ��ȤС��Ϊ��̽�����缫�ڵ���е����ã���Ʋ���������ʵ������¼����:
��� | �缫���� | �������Һ | ������ָ��ƫת���� |
1 | Al��Cu | ϡ���� | ƫ��Cu |
2 | Al��C��ʯī�� | ϡ���� | ƫ��ʯī |
�ش����У�1������2��С��:
��ʵ��1��Al���ĵ缫Ϊ____(��������������������)��Cu���ĵ缫Ϊ____(��������"����������)��
��ʵ��2�۲쵽C(ʯī)���ϲ�����������____,�����ĵ缫��ӦʽΪ____.��ͼ�ǵ����Ϊϡ������Һ������ȼ�ϵ�ء��õ�صĵ��Ӵӵ缫____������������缫____(��a��b)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����װ�[(CH3)2NH]��ˮ�е����백���ƣ�![]() �������£���0. l00mol/L��HCl�ֱ�ζ�20. 00mLŨ�Ⱦ�Ϊ0.l00mol/L��NaOH�Ͷ��װ���Һ����õζ���������Һ�ĵ絼�ʱ仯������ͼ��ʾ������˵����ȷ����
�������£���0. l00mol/L��HCl�ֱ�ζ�20. 00mLŨ�Ⱦ�Ϊ0.l00mol/L��NaOH�Ͷ��װ���Һ����õζ���������Һ�ĵ絼�ʱ仯������ͼ��ʾ������˵����ȷ����

A.b����Һ��![]()
B.d����Һ��![]()
C.e����Һ�У�![]()
D.a��b ��c��d���Ӧ����Һ�У�ˮ�ĵ���̶ȣ�![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������Ϊ36.5%��Ũ���ᣨ�ܶ�Ϊ1.16gcm��3�����Ƴ�1molL��1��ϡ���ᡣ��ʵ���ҽ���Ҫ��������220mL���Իش��������⣺
��1������ϡ����ʱ��Ӧѡ������Ϊ___������ƿ��
��2����������Ҫ___mLŨ���ᣬ����ȡʱ��ѡ��������Ͳ�е�___��
A��5mL B��10mL C��25mL D��50mL
��3�������������У������õ�����___��ѡ��ţ���
����Ͳ �ڲ����� ��ҩ�� ������ƿ ���ձ� ��̨�� �߽�ͷ�ι� ��ϸ���Լ�ƿ ���ǩֽ
��4����ʵ����������������������������ʵ���Ũ���к�Ӱ�죨����ƫ��������ƫ������������������
������ƿϴ�Ӻ�����������ˮ��___����δ����ȴ����Һע������ƿ�У�___��
��ҡ�Ⱥ���Һ���½��ټ�ˮ��___���ܶ���ʱ���ӹ۲�Һ�棬___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪FeS���������У�����FeCl2��H2S���塣�ֽ�100mL2.0mol/L��������뵽һ������FeS�����У����Ʊ�H2S���塣��������ȫ��Ӧ��ٶ���Һ������䡣
�Լ��㣺(1)���ռ�����H2S�����ڱ�״���µ����___________________;
(2)��Ӧ����Һ��FeCl2�����ʵ���Ũ��_________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����̼��þ [AlaMgb(CO3)c(OH)deH2O] ������������θ�ס���ȡ3.01 g��̼��þ��Ʒ������50 mL 2 molL -1������(����)���ռ�������112 mL(��״��)����������Һ�м���40 mL 3 molL-1��NaOH��Һ�����ˣ������ó���ϴ�ӡ���������ù���1.74 g���ٽ���Һϡ�͵�100 mL�������Һ��OH����Ũ��Ϊ0.1 molL -1���ɼ���ɵ�e��ֵΪ
A. 4B. 5C. 7D. 8
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ף�clopidogrel����һ����������ѪС��ۼ���ҩ���2-�ȱ���ȩΪԭ�ϵĺϳ�·�����£�

��1������C����������Ϊ__________���������ķ���ʽΪ____________��
��2��X�Ľṹ��ʽΪ_____________��
��3��������C����һ�������·�Ӧ�����ɵ��л������к���3����Ԫ����д���÷�Ӧ�Ļ�ѧ����ʽ��_____________________��
��4������D��ij��ͬ���칹��G��������������
�� ������������ȡ������������һ��ȡ��������̼ԭ�ӣ��� ��D�еĹ�������ͬ����G�ܷ���������Ӧ�������������G��_______�֡�
��5����֪��![]()
�����з�����д������ϩ-�״�Ϊ�л�ԭ���Ʊ�������![]() �ĺϳ�·������ͼ�����Լ���ѡ���������ÿ����Ӧ�ķ�Ӧ���͡�_____________________ʾ�����£�
�ĺϳ�·������ͼ�����Լ���ѡ���������ÿ����Ӧ�ķ�Ӧ���͡�_____________________ʾ�����£�

�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com