
【题目】某校化学兴趣小组为探究铁与浓硫酸反应,设计了如图所示装置进行实验。
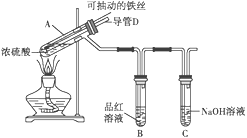
(1)已知C中盛有足量的氢氧化钠溶液,实验过程中,观察到B中的品红溶液褪色,C中发生反应的离子方程式为______________________________。一段时间后,观察到C中有少量气泡冒出,此气泡的成分是________________。
(2)用“可抽动的铁丝”代替“直接投入铁片”的优点是_____________________________;
(3)导管D作用是___________________________________________________。
(4)反应结束后,不需要打开胶塞,就可使装置中残留气体完全被吸收,应当采取的操作是_____。
(5)设计实验检验反应后试管A中所得溶液里是否含有亚铁离子,可选用的试剂为(_____)
A. NaOH溶液 B. 铁氰化钾溶液
C. KSCN溶液和双氧水 D.酸性高锰酸钾溶液
【答案】 SO2+2OH-===SO32-+H2O H2 便于控制铁与浓硫酸反应的发生和停止 停止加热时,防止倒吸或平衡压强(凡合理答案均可) 从D管口向A中鼓入大量的空气 BD
【解析】试题分析:在常温下铁遇浓硫酸发生钝化,在加热条件下可以溶解,浓硫酸被还原为二氧化硫,当硫酸的浓度降低到一定程度后,可以与铁反应生成氢气。
(1)B中的品红溶液褪色,说明反应中有二氧化硫生成,C中盛有足量的氢氧化钠溶液,则C中发生反应的离子方程式为SO2+2OH-===SO32-+H2O。一段时间后,观察到C中有少量气泡冒出,说明此气体不与碱反应,则此气泡的成分是氢气。
(2)用“可抽动的铁丝”代替“直接投入铁片”的优点是便于控制铁与浓硫酸反应的发生和停止;
(3)导管D作用是停止加热时,防止倒吸或平衡压强。
(4)反应结束后,不需要打开胶塞,就可使装置中残留气体完全被吸收,应当采取的操作是从D管口向A中鼓入大量的空气。
(5)由于溶液中可能有+3价铁离子的干扰,所以检验亚铁离子应该用+3价铁离子不能干扰的方法,如用铁氰化钾溶液(遇亚铁离子生成深蓝色沉淀)或酸性高锰酸钾溶液(遇亚铁离子褪色)检验,因此可选用的试剂为BD。


科目:高中化学 来源: 题型:
【题目】将质量为6.3g的Na2SO3暴露在空气中一段时间后溶于水配成100mL溶液.取出50mL,加入过量的稀硫酸溶液得到气体在标准状况下的体积为0.448L;另取该溶液50mL加入足量的氯化钡溶液,求生成的白色沉淀的成分及其质量.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】尿素是第一个人工合成的有机物。下列关于尿素的叙述中不正确的是( )
A.尿素是一种氮肥
B.尿素是人体新陈代谢的一种产物
C.尿素能发生水解反应
D.尿素是一种酸性物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.多项选择题。如下图所示,下列关于该物质(EGG)的叙述不正确的是(____)
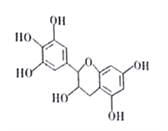
A.EGG的分子式为C15H14O7
B.EGG可在NaOH的醇溶液中发生消去反应
C.1molEGG与NaOH溶液 、溴水反应分别消耗5mol、4mol
D.EGG的核磁共振氢谱上有10组峰
Ⅱ.氯贝特是临床上一种降脂抗血栓药物,其结构如图所示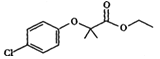 。它的一条合成路线如下:提示:(图中部分反应条件及部分反应物、生成物已略去)
。它的一条合成路线如下:提示:(图中部分反应条件及部分反应物、生成物已略去)
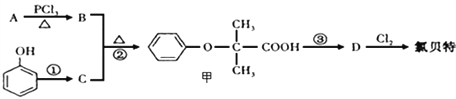
已知: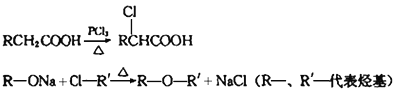
(1)A的结构简式是________________,A→B的反应类型是____________。
(2)氯贝特的官能团名称为__________,写出氯贝特与足量NaOH溶液反应的化学方程式是_________________________________________________。
(3)要实现反应①所示的转化,加入下列物质不能达到目的的是__________。
a.NaOH b.NaCl c.NaHCO3 d. Na
(4)写出D→氯贝特的化学方程式为______________________。
(5)有机物甲有多种同分异构体,则同时满足以下条件的甲的所有同分异构体有__________种。①苯环上有2个取代基;②属于酯类;③既能与FeCl3溶液反应显紫色,又能发生银镜反应。其中峰面积比为1:2:2:6:1的结构简式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是2SO2(g) + O2(g) = 2SO3(g)反应过程中的能量变化, 已知1mol SO2(g)完全氧化为1mol SO3的ΔH= —99kJ·mol-1,请回答下列问题:
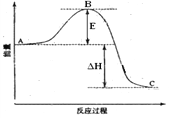
(1)图中A、C分别表的物质是__________________、________________,E的大小对该反应的焓变有无影响?___________(填“有”或“无”)(该反应通常用V2O5作催化剂,加V2O5会使图中B点降低。);
(2)图中△H = _____________kJ·mol-1;
(3)已知:S(s) + O2(g) = SO2(g) ΔH=-296 kJ·mol-1,计算由3 mol S(s)与氧气反应生成3 molSO3(g)的△H = ______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是周期表中原子序数小于20的某些元素的单质的沸点与原子序数的关系,图中的原子序数是连续的. 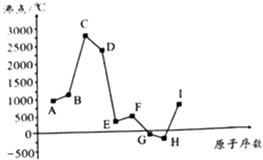
试根据图,回答下列问题:
(1)E元素在元素周期表中的位置是 .
(2)上述元素所形成的气态氢化物中最稳定的是(写化学式).
(3)上述元素中,最容易形成离子键的两种元素所形成的化合物是(写电子式).
(4)A和I两种元素相比,金属性较强的是(写元素符号),请你列举事实加以说明 .
(5)B和C的单质、A的最高价氧化物对应的水化物的水溶液三者可形成原电池,该原电池负极的电极反应式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活、社会发展息息相关。下列说法正确的是
A. 有人称“一带一路”是“现代丝绸之路”,丝绸的主要成分是纤维素
B. 聚乳酸酯的降解和油脂的皂化都是高分子生成小分子的过程
C. 疫苗一般应冷藏存放,其目的是避免蛋白质变性
D. “玉兔二号”的太阳能电池帆板的材料是二氧化硅
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com