
| 实验 装置 | 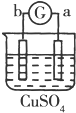 | 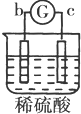 | 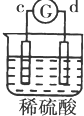 | 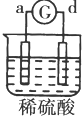 |
| 部分实验现象 | a极质量减小b极质量增加 | c极有气体产生 b极质量减轻 | d极溶解c极有气体产生 | 电流从a极流向d极 |
| A. | a>b>c>d | B. | b>c>d>a | C. | d>a>b>c | D. | a>b>d>c |
分析 一般来说,由两种金属构成的原电池中,较活泼的金属作负极、较不活泼金属作正极,负极上失电子发生氧化反应、正极上得电子发生还原反应,放电时电解质溶液中阴离子向负极移动,电流从正极流向负极,据此分析解答.
解答 解:一般来说,由两种金属构成的原电池中,较活泼的金属作负极、较不活泼金属作正极,负极上失电子发生氧化反应、正极上得电子发生还原反应,放电时电解质溶液中阴离子向负极移动,电流从正极流向负极,
a、b构成的原电池中,a极质量减小b极质量增加,说明a被腐蚀、b被保护,所以金属活动性a>b;
b、c构成的原电池中,放电时电解质溶液中SO42-向b极移动,则b为负极、c为正极,金属活动性b>c;
c、d构成的原电池中,d极溶解c极有气体产生,说明d被腐蚀、c被保护,则金属活动性d>c;
a、d构成的原电池中,电流从a极流向d极,则金属活动性d>a,
通过以上分析知,金属活动性强弱顺序是d>a>b>c,故选C.
点评 本题考查金属活动性强弱顺序判断,明确原电池中电子流向、电流流向、金属的腐蚀与防护与金属活动性强弱关系即可解答,题目难度不大.


 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:多选题
| A. | 含有离子键的化合物一定是离子化合物 | |
| B. | 同种非金属元素间不可能形成离子键 | |
| C. | 非金属元素间不可能形成离子化合物 | |
| D. | 分子中一定存在共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水玻璃可用作木材防火剂 | B. | 用大量的二氧化硫作食品漂白剂 | ||
| C. | 硅可用于制造太阳能电池 | D. | 食醋可作除去保温瓶的水垢 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | ${\;}_{53}^{135}$I是碘的一种同素异形体 | |
| B. | ${\;}_{53}^{135}$I位于元素周期表中第5周期ⅦA族 | |
| C. | ${\;}_{53}^{135}$I是一种新发现的元素 | |
| D. | ${\;}_{53}^{135}$I核内的中子数与核外电子数之差为29 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
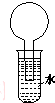 如图所示的装置是某次实验最初的情况(夹持装置省略),烧瓶内盛有等体积的甲烷和Cl2,用光照射烧瓶一段时间,下列说法正确的是( )
如图所示的装置是某次实验最初的情况(夹持装置省略),烧瓶内盛有等体积的甲烷和Cl2,用光照射烧瓶一段时间,下列说法正确的是( )| A. | 只能生成CH3Cl一种有机物 | B. | 烧瓶内液面不可能上升 | ||
| C. | 大试管内的液体可能会分层 | D. | 向水中加入石蕊试液后变红 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
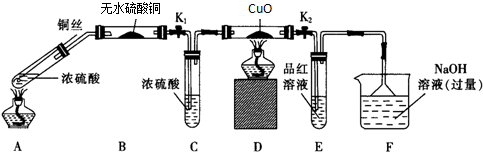
 利用下列反应:Fe+2Fe3+═3Fe2+,设计一个化学电池(给出若干导线和一个小灯泡,电极材料和电解液自选):①画出实验装置图;②注明正负极材料和电解质溶液;③标出电子流动方向.
利用下列反应:Fe+2Fe3+═3Fe2+,设计一个化学电池(给出若干导线和一个小灯泡,电极材料和电解液自选):①画出实验装置图;②注明正负极材料和电解质溶液;③标出电子流动方向.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 电解水若生成33.6L(标准状况)气体时电路中通过的电子数目为2NA | |
| B. | 5NH4NO3=2HNO3+4N2↑+9H2O反应中,生成56gN2时,转移电子数目为7.5NA | |
| C. | 用2mL5mol/L的FeCl3溶液制成的氢氧化铁胶体中所含胶粒数为0.01NA | |
| D. | 56g铁片投入足量浓H2SO4中生成NA个SO2分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
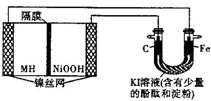 如图中的左侧装置是一种金属氢化物镍电池,其中的MH是吸附了氢原子的储氢合金,电解质溶液KOH.右侧装置是一电解池,电极材料及电解质溶液如图所示,下列有关此实验的叙述中,正确的是( )
如图中的左侧装置是一种金属氢化物镍电池,其中的MH是吸附了氢原子的储氢合金,电解质溶液KOH.右侧装置是一电解池,电极材料及电解质溶液如图所示,下列有关此实验的叙述中,正确的是( )| A. | 放电时负极反应为:MH+OH-=M+H2O+e- | |
| B. | 充电时隔膜旁的OH-从右向左移动 | |
| C. | 右侧装置中的铁电极附近溶液呈蓝色 | |
| D. | 右侧装置中的碳电极表面逸出无色、无味的气体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com