
【题目】已知:25 ℃时,CH3COOH和NH3·H2O的电离常数相等。
(1)25 ℃时,取10 mL 0.1 mol·L-1醋酸溶液测得其pH=3。将溶液加水稀释至100 mL,溶液pH数值范围为___________,溶液中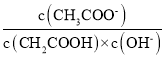 ____(填“增大”“减小”“不变”或“不能确定”)。
____(填“增大”“减小”“不变”或“不能确定”)。
(2)25 ℃时,0.1 mol·L-1氨水(NH3·H2O溶液)的pH=______;
(3)某温度下,向V1mL 0.1 mol·L-1NaOH溶液中逐滴加入等浓度的醋酸溶液,溶液中pOH与pH的变化关系如图。已知:pOH=- lgc(OH-)。图中M、Q、N三点所示溶液中水的电离程度最大的点是___________。

【答案】3<pH<4 不变 11 Q
【解析】
(1)醋酸是弱酸加水稀释醋酸电离程度增大,溶液中存在离子积常数,结合比值关系和电离平衡常数分析;
(2)25℃时,CH3COOH和NH3H2O的电离常数相等,25℃时,0.1mol/L氨水(NH3H2O溶液)电离出的氢氧根离子浓度为10-3mol/L;
(3)图象分析可知N点pH>pOH,溶液显碱性,M点pOH>pH,溶液显酸性,酸碱抑制水的电离,Q点pOH=pH,溶液显中性。
(1)25℃时,取10mL 0.1mol/L醋酸溶液测得其pH=3,溶液加水稀释至100mL,氢离子浓度减小,pH大于3,醋酸电离被促进又电离出氢离子,氢离子浓度减小小于稀释10倍后的H+浓度,则溶液pH小于4,溶液pH取值范围为:3<pH<4,溶液中离子浓度之比=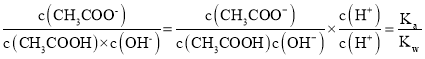
![]() ,电离平衡常数和离子积常数随温度变化,所以加水稀释溶液中
,电离平衡常数和离子积常数随温度变化,所以加水稀释溶液中 不变;
不变;
(2)25℃时,CH3COOH和NH3H2O的电离常数相等,25℃时,0.1mol/L氨水(NH3H2O溶液)电离出的氢氧根离子浓度为10-3mol/L,溶液pH=11;
(3)图象分析可知N点pH>pOH,溶液显碱性,M点pOH>pH,溶液显酸性,酸碱抑制水的电离,Q点pOH=pH,溶液显中性,水的电离程度最大,故答案为:Q。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】工业上可利用CO2来制备清洁液体颜料甲醇,有关化学反应如下:
反应Ⅰ:CO2(g)+3H2(g)CH3OH(g)+H2O(g) △H1=﹣49.6kJmol-1
反应Ⅱ:CO2(g)+H2(g)H2O(g)+CO(g) △H2=+41kJmol-1
(1)反应Ⅰ在___(填“低温”或“高温”)下可自发反应。
(2)有利于提高上述反应甲醇平衡产率的条件是___。
A.高温高压 B.低温低压 C.高温低压 D.低温高压
(3)在Cu﹣ZnO/ZrO2催化下,CO2和H2混合气体,体积比1:3,总物质的量amol进行反应,测得CO2转化率、CH3OH和CO选择性随温度、压强变化情况分别如图所示(选择性:转化的CO2中生成CH3OH或CO的百分比)。

①下列说法正确的是___。
A.压强可影响产物的选择性
B.CO2平衡转化率随温度升高先增大后减小
C.由图1可知,反应的最佳温度为220℃左右
D.及时分离出甲醇和水以及使氢气和二氧化碳循环使用,可提高原料利用率
②250℃时,反应Ⅰ和Ⅱ达到平衡,平衡时容器体积为VL,CO2转化率为25%,CH3OH和CO选择性均为50%,则该温度下反应Ⅱ的平衡常数为___。
③分析图2中CO选择性下降的原因___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,电化学原理与微生物工艺相组合的电解脱硝法,可除去引起水华的NO3-原理是将NO3-还原为N2。下列说法正确的是( )
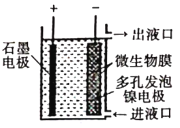
A. 若加人的是![]() 溶液,则导出的溶液呈碱性
溶液,则导出的溶液呈碱性
B. 镍电极上的电极反应式为:![]()
C. 电子由石墨电极流出,经溶液流向镍电极
D. 若阳极生成![]() 气体,理论上可除去
气体,理论上可除去![]() mol
mol![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,0.1 mol/L的H2C2O4溶液中H2C2O4、HC2O4-、C2O42-三者中所占物质的量分数(分布系数)随pH变化的关系如图所示。下列表述不正确的是( )
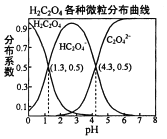
A.HC2O4-![]() H++C2O42-,K=1×10-4.3
H++C2O42-,K=1×10-4.3
B.将等物质的量的NaHC2O4、Na2C2O4溶于水中,所得溶液pH恰好为4.3
C.常温下HF的K=1×10-3.45,将少量H2C2O4溶液加入到足量NaF溶液中,发生的反应为:H2C2O4+F-=HF+HC2O4-
D.在0.1 mol/LNaHC2O4溶液中,各离子浓度大小关系为:c(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在湿法炼锌的电解循环溶液中,较高浓度的![]() 会腐蚀阳极板而增大电解能耗。可向溶液中同时加入Cu和CuSO4,生成CuCl沉淀从而除去
会腐蚀阳极板而增大电解能耗。可向溶液中同时加入Cu和CuSO4,生成CuCl沉淀从而除去![]() 。根据溶液中平衡时相关离子浓度的关系图,下列说法错误的是
。根据溶液中平衡时相关离子浓度的关系图,下列说法错误的是

A. ![]() 的数量级为
的数量级为![]()
B. 除![]() 反应为Cu+Cu2++2
反应为Cu+Cu2++2![]() =2CuCl
=2CuCl
C. 加入Cu越多,Cu+浓度越高,除![]() 效果越好
效果越好
D. 2Cu+=Cu2++Cu平衡常数很大,反应趋于完全
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是部分短周期元素(用字母x等表示)化合价与原子序数的关系图。

根据判断出的元素回答问题:
(1)h在周期表中的位置是__________。
(2)比较z、f、g、r常见离子的半径大小(用化学式表示,下同):______>______>______>______;比较r、m的最高价氧化物对应水化物的酸性强弱:______>______>;比较d、m的氢化物的沸点:______>______。
(3)x与氢元素能形成多种化合物,其中既含极性键又含非极性键,且相对分子质量最小的物质是(写分子式)______,实验室制取该物质的化学方程式为:____________________________________。
(4)由y、m和氢元素组成一种离子化合物,写出其电子式:___________________________。
(5)用铅蓄电池作电源,惰性电极电解饱和em溶液,则电解反应的生成物为(写化学式)___________________________。铅蓄电池放电时正极反应式为式)___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫及其化合物有许多用途,相关物质的物理常数如下表所示:
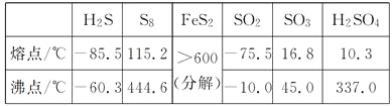
回答下列问题:
(1)基态Fe原子价层电子的电子排布图(轨道表达式)为____________________________,基态S原子电子占据最高能级的电子云轮廓图为________形。
(2)根据价层电子对互斥理论,H2S、SO2、SO3的气态分子中,中心原子价层电子对数不同于其他分子的是__。
(3)图(a)为S8的结构,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为__________________。
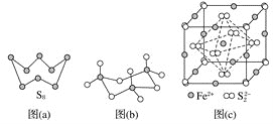
(4)气态三氧化硫以单分子形式存在,其分子的立体构型为________形,其中共价键的类型有________种;固体三氧化硫中存在如图(b)所示的三聚分子,该分子中S原子的杂化轨道类型为________。
(5)FeS2晶体的晶胞如图(c)所示。晶胞边长为anm、FeS2相对式量为M、阿伏加德罗常数的值为NA,其晶体密度的计算表达式为______________________________g·cm-3;晶胞中Fe2+位于![]() 所形成的正八面体的体心,该正八面体的边长为________nm。
所形成的正八面体的体心,该正八面体的边长为________nm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课题组从植物香料中分离出一种罕见的醇(醇A),其结构简式如下。
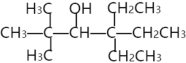
(1)根据课内所学知识,该醇可发生的反应包括:___(填字母序号)
A.与金属Na反应 B.与CuO反应
C.与浓盐酸反应 D.消去反应
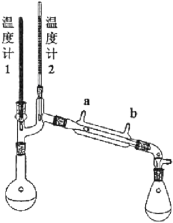
I.该课题组设计了以醇A为原料制备某物质的合成路线。合成反应的第一步。拟使醇A与浓氢溴酸(质量分数47.6%)在90℃下充分反应,制备中间产物B。实验装置如图所示(夹持及加热仪器略去)。
已知:①HBr溶液受热时,HBr能否蒸发受到体系汇总含水量的影响。具体情况如下表。
| <47.6% | 47.6% | >47.6% |
先蒸发的物质 | 水先蒸发,直至比值升至47.6% | HBr与水按该比例一起蒸发、液化沸点124.3℃ | HBr先蒸发,直至比值降至47.6% |
②醇A、中间产物B的沸点均超过200℃。
(2)温度计1拟用于监控反应温度,温度计2拟用于监控实验中离开烧瓶的物质的沸点。两个温度计中,水银球位置错误的是___(填“温度计1”或“温度计2”)其水银球应___;
(3)实验时,冷凝水应从冷凝管的___(填“a口”或“b口”)流入。
II.将温度计位置调节好后,课题组成员依次进行如下操作:
①检验气密性,装入沸石;
②加入18.6g醇A(0.1mol)、17.0g47.6%氢溴酸(含8.1gHBr、0.1mol);
③开始加热,逐渐升温至反应温度。
(4)反应开始后,当温度计2的示数上升至39℃时,冷凝管末端持续有液体流出。反应结束时,共收集到无色液体7.0g。经检测,该液体为纯净物,标记为产物C。取0.7gC在氧气中充分燃烧,共收集到2.2gCO2、0.9gH2O。另取少量C进行质谱试验,结果如图所示。
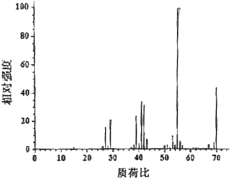
根据上述实验结果,C的分子式为___;
(5)取少量产物C进行核磁共振氢谱试验,共有三个信号峰。三个信号峰的面积之比为3:6:1。综合上述实验结果,C的结构简式为___;
(6)反应结束后,圆底烧瓶内液体分为两层。可用___方法(填实验操作名称)将两液体分离;
(7)后续检验证实,两液体均较纯净,其中所含杂质均可忽略。上层液体质量为10.7g。取下层液体进行核磁共振氢谱实验,共有两个信号峰。峰的面积之比为3:2。综合以上信息,本实验的实际总反应方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】大气与生态圈的氮循环如图所示,下列叙述不正确的是

A. ④维持大气中氮元素含量稳定
B. ①是野生植物生长所需氮元素的重要来源
C. ⑤为硝化过程、④为反硝化过程,都是氮元素的还原反应过程
D. ②是氮肥工业基础,科学家努力将固氮变化条件趋近生物固氮
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com