

分析 A为氨气的发生装置,B为干燥装置,E中浓硫酸起干燥N2作用,在D中用碱石灰防止空气进入F装置,防止Mg3N2水解,D装置用冰水冷却水蒸气.
(1)根据气体与固体在加热条件下反应,必须先干燥;
(2)根据反应物的状态和反应的条件可知;
(3)装置D中U型管内液体为水;
(4)根据氧化还原反应方程式中得失电子相等进行计算;
(5)Mg3N2易水解的成Mg(OH)2和NH3,b值增大.
解答 解:(1)水气化吸大量热,为此,气体与某固体在加热条件下反应之前必须要干燥,否则不能达到所需温度,
干燥管,干燥N2;
(2)由“固+固$\frac{\underline{\;加热\;}}{\;}$气体”可知应选I,其中反应的化学方程式为:Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,
故答案为:I,Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
(3)水中有三种微粒(H2O、H+、OH-),新制氯水中有七种微粒(H2O、HClO、Cl2、H+、Cl-、ClO-、OH-),
故答案为:后者多;
(4)参加反应的氮气质量为(b-a)g,反应中失电子数为$\frac{b-a}{14}$×3,也即为CuO得电子数.CuO的物质的量为$\frac{(b-a)×3}{14×2}$=$\frac{3(b-a)}{28}$mol.实验测得氮化镁中镁、氮的原子个数比为:$\frac{\frac{a}{24}}{\frac{b-a}{14}}$=$\frac{7a}{12(b-a)}$
故答案为:$\frac{3(b-a)}{28}$mol;$\frac{7a}{12(b-a)}$;
(5)Mg3N2易水解的成Mg(OH)2和NH3,b值增大.(b-a)的值变大,即为氮的量增大,镁、氮的原子个数比变小,
故答案为:偏小.
点评 本题考查了氨气的制取和性质检验,涉及了实验装置的选择、化学方程式的书写,本题难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 未冷却就转移、定容 | B. | 容量瓶原有少量蒸馏水 | ||
| C. | 定容时俯视刻度线观察液面 | D. | 量筒取浓盐酸时,俯视读数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
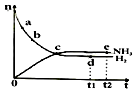 合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:
合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:| A. | 点d(t1时刻)和点e(t2时刻)处n(N2)不一样 | |
| B. | 点c处反应达到平衡 | |
| C. | 点a的正反应速率比点b的大 | |
| D. | 其他条件不变,773 K下反应至t1时刻,n(H2)比图中d点的值小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
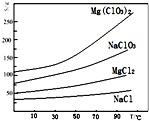 氯酸镁[Mg(ClO3)2]常用作催熟剂、除草剂等,实验室用卤块(主要成分为MgCl2•6H2O,含有MgSO4、FeCl2等杂质)制备少量Mg(ClO3)2•6H2O的流程如下:
氯酸镁[Mg(ClO3)2]常用作催熟剂、除草剂等,实验室用卤块(主要成分为MgCl2•6H2O,含有MgSO4、FeCl2等杂质)制备少量Mg(ClO3)2•6H2O的流程如下:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
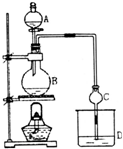 某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中盛有饱和碳酸钠溶液.
某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中盛有饱和碳酸钠溶液.| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点(℃) | 34.7 | 78.5 | 118 | 77.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 对于同一个化学反应,一步完成和分几步完成,其反应的焓变不相同 | |
| B. | 如果某化学反应的△H和△S均小于0,则反应一定能自发进行 | |
| C. | 化学反应过程中,断键吸热,成键放热 | |
| D. | 反应物的总焓大于反应产物的总焓时,△H>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①⑤③⑦⑥④② | B. | ①⑤⑦③④⑥② | C. | ①⑦③⑤⑥④② | D. | ①⑦③④⑥⑤② |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质类别 | 分类依据 | |
| A | 酸 | 电离时能否产生氢离子 |
| B | 碱性氧化物 | 是否属于金属氧化物 |
| C | 胶体 | 能否发生丁达尔现象 |
| D | 电解质 | 在水溶液中或熔化状态下能否电离 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com