
乙酰紫草素具有抗菌、抗炎、抗病毒、抗肿瘤等作用,它的结构简式如右图所示,下列有关乙酰紫草素的说法错误的是
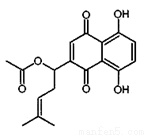
A. 该分子中含有1个手性碳原子
B. 能与FeCl3溶液发生显色反应
C. 1mol 乙酰紫草素最多可与2molBr2反应
D. 1mol乙酰紫草素最多可与2molNaOH反应
科目:高中化学 来源:2016-2017学年山东省济南市高一下学期开学考试化学试卷(解析版) 题型:选择题
为了检验某FeCl2溶液是否变质,可向溶液中加入( )
A. NaOH B. 铁片 C. KSCN溶液 D. 石蕊溶液
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省高二下学期学业水平模拟化学试卷(解析版) 题型:选择题
实验室用下图装置制取CO2。下列说法错误的是
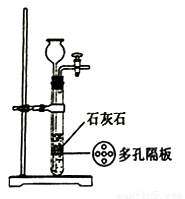
A. 关闭活塞,向长颈漏斗中加水可检査装置的气密性
B. 通常用稀盐酸和块状石灰石反应
C. 旋转活塞可以控制反应的进程
D. 用澄清石灰水可除去CO2中混有的HCl气体
查看答案和解析>>
科目:高中化学 来源:东北三省四市教研联合体2017届高三高考模拟试卷(一)理综化学试卷 题型:选择题
下列有关有机物的说法正确的是
A. 甲烷不能发生氧化反应 B. 乙烯和苯均能发生加成反应
C. 乙醇和乙酸乙酯都易溶于水 D. 甲苯中所有原子可能处于同一平面
查看答案和解析>>
科目:高中化学 来源:2017届江苏省高三下学期期初考试化学试卷(解析版) 题型:简答题
电镀污泥主要含有Cr2O3、NiO和Fe2O3等物质,可制备Na2Cr2O7溶液和NiSO4·6H2O晶体,实现有害物质的资源化利用。已知黄钠铁矾[NaFe3(SO4)2(OH)6]是一种浅黄色的难溶物,具有沉淀颗粒大、沉降速率快、容易过滤的特点。
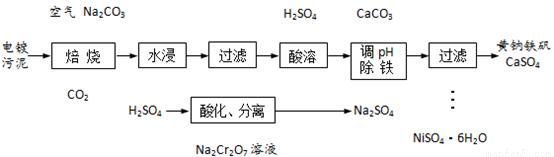
(1)焙烧时Cr2O3被氧化为Na2CrO4,该反应的化学方程式为_______________。
(2)写出酸化时CrO42-转化为Cr2O72-的离子方程式:_________________。
(3)①加入CaCO3的目的是中和溶液中的酸,调节溶液pH,提高铁的去除率。溶液pH对除铁效率影响如下图所示。
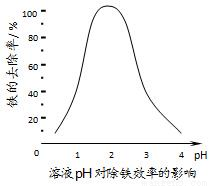
则除铁时应控制溶液的pH为____________(填序号)。
A.0.5~1.5 B.1.5~2.5 C.2.5~3.5
②除铁时发生反应的离子方程式为___________。
③若除铁时pH稍大会生成Fe(OH)3胶体,显著降低除铁效率,原因是____________。
(4)从滤液中获取NiSO4·6H2O晶体的操作为________、冷却结晶、过滤、_________、干燥。
查看答案和解析>>
科目:高中化学 来源:2017届江苏省高三下学期期初考试化学试卷(解析版) 题型:选择题
下列有关实验原理或实验操作正确的是
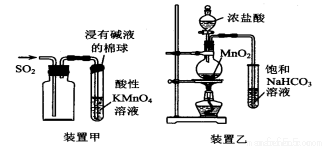
A. 用装置甲收集SO2并验证其漂白性
B. 用装置乙验证氯气与水反应有盐酸生成
C. 用NaOH溶液除去苯中混有的少量苯酚,反应后分液
D. 用澄清石灰水鉴别苏打溶液和小苏打溶液
查看答案和解析>>
科目:高中化学 来源:2017届海南省高三第七次月考化学试卷(解析版) 题型:简答题
下图是某化学研究性学习小组设计的铜与稀硝酸反应的两个实验装置图。其中装置I为甲同学设计。
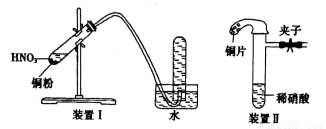
请回答下列问题:
(1)铜与稀硝酸反应的离子方程式为:__________________。
(2)装置I的试管中收集到NO,乙同学认为这也不能确定铜与稀硝酸反应生成的气体是NO,理由是______________________。于是他设计装置II,其中装铜片的是气球。
(3)研究性小组的同学共同对上述实验进行了研究,认为装置II虽然作了改进,但如果按装置II进行实验,还存在问题,需要作相应改进。
①问题一:反应速度较慢。
措施:___________或_________________。
②问题二:试管中的气体是淡棕红色,而不是无色。
措施:现将少量的固体________倒入试管,然后迅速系上装有铜的小气球。
A.Na2SO4 B. CH3COONa C. NaHCO3
③问题三:____________________。
措施:____________________。
查看答案和解析>>
科目:高中化学 来源:2017届陕西省高三上学期第二次模考化学试卷(解析版) 题型:填空题
铝是地壳中含量最高的金属元素,其单质及合金在生产生活中的应用日趋广泛。
(1)真空碳热还原-氯化法可实现由铝土矿制备金属铝,其相关反应的热化学方程式如下Al2O3(s)+AlCl3(g)+3C(s) =3AlCl (g)+3CO(g) △H = a kJ·mol-1
3AlCl(g)=2Al(l)+ AlCl3 (g) △H = b kJ·mol-1
①反应Al2O3(s)+3C(s)=2Al(l)+3CO(g)的△H=________kJ·mol-1(用含a、b的代数式表示)。
②Al4C3也是该反应过程中的一种中间产物。Al4C3 与盐酸反应(产物之一是含氢量最高的烃)的化学方程式为_______________。
③甲烷和水反应可以制水煤气(混合气体),在恒温、固定体积为V升的密闭容器中的反应微观示意图如下所示,根据微观示意图得出的结论中,正确的是_____________。


一定条件下经过t分钟达到化学平衡
a. 该反应方程式为:CH4+H2O = CO+3H2
b. 该反应平衡前后压强比为3:4
c. 该反应体系中含氢元素的化合物有3种
d. 该反应中甲烷的平衡转化率为50%
④水煤气中的H2可用于生产NH3,在进入合成塔前常用[Cu(NH3)2]Ac溶液来吸收其中的CO,防止合成塔中的催化剂中毒,其反应是:
[Cu(NH3)2]Ac(aq) + CO(g) + NH3(g)  [Cu(NH3)3]Ac·CO(aq) △H<0
[Cu(NH3)3]Ac·CO(aq) △H<0
[Cu(NH3)2]Ac溶液吸收CO的适宜生产条件应是____________________。该条件下用气体表示的平衡常数表达式为:K=______________
(2)镁铝合金(Mg17Al12 )是一种潜在的贮氢材料,一般在氩气环境中将一定化学计量比的Mg、Al 单质在一定温度下熔炼获得。该合金在一定条件下可完全吸氢得到的混合物Y(含MgH2 和Al),Y在一定条件下可释放出氢气。
①熔炼制备镁铝合金(Mg17Al12)时通入氩气的目的是_________________。
②写出镁铝合金(Mg17Al12 ) 在一定条件下完全吸氢的化学方程式 _________________。
③在6. 0 mol·L-1 HCl 溶液中,混合物Y 能完全释放出H2。1 mol Mg17 Al12 完全吸氢后得到的混合物Y 与上述盐酸完全反应,释放出H2 的物质的量为_________。
查看答案和解析>>
科目:高中化学 来源:2017届浙江省高三3月选考化学试卷(解析版) 题型:选择题
在一容积为2L的恒温恒容密闭容器中充入2mol SO2和1mol O2,发生反应2SO2(g)+O2(g)  2SO3(g) △H=-Q kJ·mol-l (Q>O),下列有关说法不正确的是
2SO3(g) △H=-Q kJ·mol-l (Q>O),下列有关说法不正确的是
A. 反应达到平衡时,放出热量为QkJ
B. 若容器的压强不再发生交化,则反应达到平衡
C. 反应过程中c(SO2)+ c(SO3)=1 mol·L-1恒成立
D. 平衡时,SO2、O2的转化率相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com