
| A. | 用量筒量取浓盐酸配制0.01mol/L稀盐酸时,量筒用蒸馏水洗净后未经干燥直接量取浓盐酸 | |
| B. | 配制稀盐酸定容时,俯视容量瓶刻度线 | |
| C. | 滴定前尖嘴处无气泡,滴定终点时有气泡 | |
| D. | 滴定过程中用少量蒸馏水将锥形瓶内避粘附的盐酸冲下 |
分析 A.量筒中的蒸馏水稀释了浓盐酸,导致浓盐酸浓度减小;
B.定容时俯视容量瓶刻度线,导致加入的蒸馏水体积偏小;
C.滴定管下端尖嘴处悬挂有一滴液滴,导致消耗的标准液的体积偏大;
D.蒸馏水不影响待测液中溶质的物质的量,对滴定结果没有影响.
解答 解:A.用量筒量取浓盐酸配制0.01mol/L稀盐酸时,量筒用蒸馏水洗净后未经干燥直接量取浓盐酸,会导致浓盐酸被稀释,导致标准液盐酸浓度减小,造成V(标准)偏大,根据c(待测)=$\frac{c(标准)×c(标准)}{V(待测)}$分析,测定结果偏大,故A正确;
B.配制稀盐酸定容时,俯视容量瓶刻度线,容量瓶中加入的蒸馏水体积偏小,导致标准液盐酸浓度偏大,造成V(标准)偏小,根据c(待测)=$\frac{c(标准)×c(标准)}{V(待测)}$分析,测定结果偏低,故B错误;
C.滴定前尖嘴处无气泡,滴定终点时有气泡,造成V(标准)偏小,根据c(待测)=$\frac{c(标准)×c(标准)}{V(待测)}$分析,测定结果偏低,故C错误;
D.滴定过程中用少量蒸馏水将锥形瓶内避粘附的盐酸冲下,对待测液物质的量没有影响,对V(标准)无影响,根据c(待测)=$\frac{c(标准)×c(标准)}{V(待测)}$分析,测定结果无影响,故D错误;
故选A.
点评 本题考查了中和滴定中的误差分析,题目难度中等,明确中和滴定操作方法为解答关键,注意根据c(待测)=$\frac{c(标准)×c(标准)}{V(待测)}$分析滴定误差,试题培养了学生的分析能力及化学实验能力.


 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:选择题
| A. | 往紫色石蕊试液中加入盐酸,溶液变红 | |
| B. | 饱和FeCl3溶液在沸水中变成红褐色胶体 | |
| C. | 向FeSO4溶液中滴加NaOH溶液,生成的沉淀由白色变成灰绿色,最后变成红褐色 | |
| D. | SO2使滴有酚酞的NaOH溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
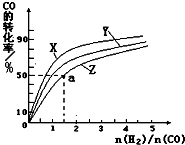 甲醇是一种新型燃料,甲醇燃料电池即将从实验室走向工业化生产.工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:CO(g)+2H2(g)?CH3OH(g)△H1=-116kJ•mol-1
甲醇是一种新型燃料,甲醇燃料电池即将从实验室走向工业化生产.工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:CO(g)+2H2(g)?CH3OH(g)△H1=-116kJ•mol-1| 0min | 5min | 10min | |
| CO | 0.1 | 0.05 | |
| H2 | 0.2 | 0.2 | |
| CH3OH | 0 | 0.04 | 0.05 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
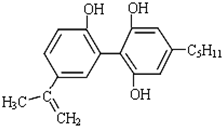
| A. | 一定条件下1mol该物质能与1molH2发生加成反应 | |
| B. | 该有机物能与FeCl3溶液发生显色反应 | |
| C. | 该有机物能与碳酸氢钠溶液反应 | |
| D. | 该有机物是苯酚的同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
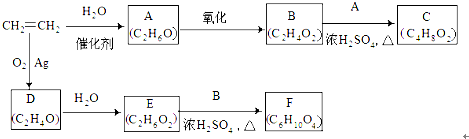
 E
E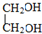 F
F 写出C酸性条件下水解的方程式CH3COOCH2CH3+H2O$?_{△}^{稀H_{2}SO_{4}}$CH3COOH+CH3CH2OH
写出C酸性条件下水解的方程式CH3COOCH2CH3+H2O$?_{△}^{稀H_{2}SO_{4}}$CH3COOH+CH3CH2OH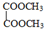 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=14的溶液中:NH4+、Al3+、Cl-、NO3- | |
| B. | 中性溶液中:Fe2+、K+、Cl-、${SO}_{4}^{2-}$ | |
| C. | 含有大量Ba2+的溶液中:Mg2+、Na+、${NO}_{3}^{-}$、Cl- | |
| D. | 由水电离出的c(H+)=1×10-12mol-1的溶液中:Na+、Mg2+、HCO3-、CH3COO- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,22g由N2O于CO2组成的混合气体中含有的原子数目为1.5NA | |
| B. | 在过氧化钠与水的反应中,每生成0.1mol氧气,转移电子的数目为0.4NA | |
| C. | 0.1mol•L-1的AlCl3溶液中含有的Cl-数目为0.3NA | |
| D. | 标准状况下,11.2L水中含有的分子数目为0.5NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com