
| A. | 原子核外电子排布决定了该原子的化学性质 | |
| B. | 根据原子序数可以推知该原子的中子数和其在周期表中的位置 | |
| C. | ${\;}_{19}^{40}$K、${\;}_{20}^{40}$Ca是具有相同质量数的同位素原子 | |
| D. | 所有的原子核都是由质子和中子组成的 |
分析 A.根据决定了该原子的化学性质的为价电子数判断;
B.根据原子序数可以推知质子数、电子层数以及最外层电子数等;
C.具有相同质子数,不同中子数同一元素的不同原子互为同位素;
D.H中不含中子.
解答 解:A.因为决定了该原子的化学性质的为价电子数,所以原子核外电子排布决定了该原子的化学性质,故A正确;
B.根据原子序数可以推知电子层数以及最外层电子数,电子层数=周期序数,最外层电子数=主族序数,可以根据主族元素原子的电子层数和最外层电子数确定其在周期表中的位置,但不能确定该原子的中子数,故B错误;
C.质子数不同,为不同元素的原子,不是同位素关系,故C错误;
D.H的原子核中没有中子,故D错误.
故选A.
点评 本题考查原子结构与元素性质,难度不大,明确元素周期表及其规律是解本题关键.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 在周期表中,氯元素位于硫元素之后,所以Cl2的氧化性弱于硫单质 | |
| B. | 硫黄中只有非极性键,S2Cl2中只有极性键 | |
| C. | 在常温常压下,硫黄是原子晶体,S2Cl2是分子晶体 | |
| D. | S2Cl2与水反应时,既体现氧化性又体现还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,D在元素周期表中的位置第3周期,第VIA族.
,D在元素周期表中的位置第3周期,第VIA族.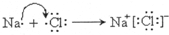 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.01 | 0.008 | 0.007 | 0.007 | 0.007 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原电池中电解质溶液能电离出自由移动的离子 | |
| B. | 有两根导线将两个活动性不同的电极连接 | |
| C. | 电极上进行的氧化还原反应的生成物为电子 | |
| D. | 电极上进行氧化还原反应时有电子的定向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
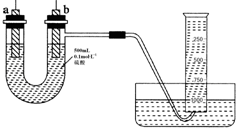 现有纯锌片、纯铜片和500mL 0.1mol•L-1的硫酸、导线、1 000mL量筒.用如下图所示装置利用原电池原理,制备一定量的氢气.
现有纯锌片、纯铜片和500mL 0.1mol•L-1的硫酸、导线、1 000mL量筒.用如下图所示装置利用原电池原理,制备一定量的氢气.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可用分液漏斗分离溴和四氯化碳 | |
| B. | CH3COOCH3核磁共振氢谱中只给出一种信号 | |
| C. | 乙醇(CH3CH2OH)和二甲醚(CH3-O-CH3)互为碳链异构体 | |
| D. | 与氢气加成得到2,3-二甲基戊烷的烯烃结构式有5种 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .从分液漏斗上口倒出的上层液体是苯.
.从分液漏斗上口倒出的上层液体是苯.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com