
【题目】环丙烷可作为全身麻醉剂,环己烷是重要的有机溶剂。下表是部分环烷烃及烷烃衍生物的结构简式、键线式和某些有机化合物的反应式(其中Pt、Ni是催化剂)。
结构简式 |
|
|
|
键线式 |
|
|
|
①![]() +H2
+H2![]()
![]()
②![]() +H2
+H2![]()
![]()
③![]() +H2
+H2![]()
![]()
④![]() +KMnO4
+KMnO4![]()
![]() +
+![]() +Mn2+
+Mn2+
回答下列问题:
(1)环烷烃与___________是同分异构体。
(2)从反应①~③可以看出,最容易发生开环加成反应的环烷烃是______(填名称),判断依据为_________。
(3)环烷烃还可与卤素单质、卤化氢发生类似的开环加成反应,如环丁烷与HBr在一定条件反应,其化学方程式为(不需注明反应条件)____________。
(4)写出鉴别环丙烷与丙烯的一种方法:试剂___________;现象与结论 __________。
【答案】同碳原子数的烯烃 环丙烷 反应所需条件(温度)要求最低 ![]() +HBr→
+HBr→![]() 酸性KMnO4溶液 能使酸性KMnO4溶液褪色的是丙烯,不褪色的是环丙烷
酸性KMnO4溶液 能使酸性KMnO4溶液褪色的是丙烯,不褪色的是环丙烷
【解析】
(1)由表中结构简式可知环烷烃的通式为CnH2n,显然与具有相同碳原子数的烯烃互为同分异构体,故答案为:相同碳原子数的烯烃(或相对分子质量相同的烯烃);
(2)比较①~③的反应条件(温度)知,①反应温度最低,故环丙烷最易发生开环加成反应,故答案为:环丙烷;反应温度最低;
(3)根据题干加成反应的信息:环结构变为链结构,不难写出所求反应的方程式为:![]() +HBr→
+HBr→![]() ,故答案为:
,故答案为:![]() +HBr→
+HBr→![]() ;
;
(4)由反应④知环烷结构不与KMnO4(H+)反应,而碳碳双键易被氧化,故用酸性KMnO4溶液可将环丙烷和丙烯区别开,故答案为:酸性高锰酸钾溶液;使酸性高锰酸钾溶液退色的是丙烯,另一种是环丙烷(或溴水,使溴水发生加成反应退色的是丙烯)。


 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案科目:高中化学 来源: 题型:
【题目】NiSO46H2O是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电池等,可由电镀废液(除含镍外,还含有Cu、Fe、Cr等杂质)为原料获得。工艺流程如图:
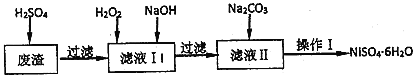
已知: 25℃时,几种金属氢氧化物的溶度积常数和完全沉淀的pH范围如下表所示。
Fe(OH)2 | Fe(OH)3 | Cr(OH)3 | Ni(OH)2 | |
Ksp | 8.0×10-16 | 4.0×10-38 | 6.0×10-31 | 6.5×10-18 |
完全沉淀pH | ≥9.6 | ≥3.2 | ≥5.6 | ≥8.4 |
注:NiCO3是一种不溶于水易溶于强酸的沉淀。
请回答下列问题:
(1)下列措施可行,且能提高废渣浸出率的有________。
A.升高反应温度 B.增大压强 C.在反应过程中不断搅拌
(2)在滤液I中加入6%的H2O2,其作用是__________(用离子方程式表示);加入NaOH调节pH的范围是_________,为了除去溶液中的_________离子。
(3)检验Ni2+已完全沉淀的实验方法是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下气体反应达到化学平衡,平衡常数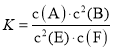 。恒容时,若温度适当降低,F的浓度增加。下列说法正确的是
。恒容时,若温度适当降低,F的浓度增加。下列说法正确的是
A.恒容时,向容器中充入稀有气体,反应速率不变
B.增大c(A)、c(B),K增大
C.该反应的化学方程式为2E(g)+F(s)A(g)+2B(g)
D.正反应为放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国成功研制出了具有自主知识产权的治疗缺血性脑梗死新药——丁苯酞。有机物G是合成丁苯酞的中间产物,G的一种合成路线如下:

已知: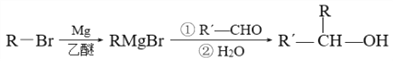
回答下列问题:
(1)A的结构简式是___________,E的化学名称是____________。
(2)由B生成C的化学方程式为______________________。
(3)G的结构简式为__________________。合成丁苯酞的最后一步转化为:
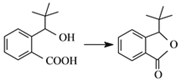 ,则该转化的反应类型是_______________。
,则该转化的反应类型是_______________。
(4)有机物D的溴原子被羟基取代后的产物J有多种同分异构体,其中含有苯环的同分异构体有______种(不包括J),其核磁共振氢谱吸收峰最多的结构简式为_________。
(5)参照题中信息和所学知识,写出用![]() 和CH3MgBr为原料(其他无机试剂任选)制备
和CH3MgBr为原料(其他无机试剂任选)制备![]() 的合成路线:______________。
的合成路线:______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,其中每个数字序号代表一种短周期元素。
| IA | 0 | |||||||
1 | ① | II A | III A | IV A | V A | VI A | VIIA | ||
2 | ② | ③ | |||||||
3 | ④ | ⑤ | ⑥ | ||||||
请按要求回答下列问题:
(1)元素③的最高价氧化物对应的水化物的化学式为 ;
(2)②、③两元素的原子半径较大的是______________(填元素符号);
(3)④和⑤两种元素的金属性较强的是 (填元素符号);
(4)元素③和元素⑥的氢化物均极易溶于水,用两根玻璃棒分别蘸取它们的浓溶液,相互接近时,可看到大量的白烟,写出产生该现象的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在产生了AgCl沉淀的试管中,加入KI溶液,白色沉淀变为黄色。下列说法正确的是( )
A.该实验说明I-还原性比Cl-强B.该实验说明Ksp(AgCl)<Ksp(AgI)
C.该实验说明AgI溶解度比AgCl小D.KI的加入对AgCl的溶解平衡没有影响
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为测定某品牌洗厕精的酸(盐酸)含量,某学生欲用已知物质的量浓度的NaOH溶液来测定该洗厕精(盐酸)的物质的量浓度时,选择酚酞作指示剂。请填写下列空白:
(1)碱式滴定管的使用方法,正确步骤的先后顺序为____(填字母)。
A.用NaOH溶液润洗仪器并加入NaOH溶液
B.放出NaOH溶液进行滴定
C.调节起始读数
D.查漏,再水洗2~3遍
(2)用标准的NaOH溶液滴定待测的盐酸时,左手控制碱式滴定管的玻璃球,右手摇动锥形瓶,眼睛应注视___。
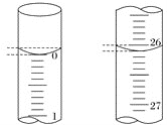
(3)若滴定开始和结束时,碱式滴定管中的液面如图所示,则所用NaOH溶液的体积为___mL。
(4)某学生根据三次实验分别记录有关数据如下表:
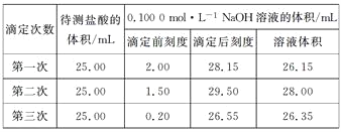
请选用其中合理的数据计算该洗厕精中酸(盐酸)的物质的量浓度:c(HCl)=____。
(5)分析下列操作对所测洗厕精的酸(盐酸)的浓度的影响:
A.若取待测液时,开始仰视读数,后俯视读数,则____(填“偏大”、“偏小”或“无影响”,下同);
B.若碱式滴定管在滴定前有气泡,滴定后气泡消失,则____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知氯气与NaOH溶液反应可生成NaCl、NaClO、NaClO3,NaClO在加热条件下可分解生成NaCl和NaClO3,现向氢氧化钠溶液中通入一定量的氯气,加热少许时间后溶液中形成混合体系,若溶液中只有NaCl、NaClO、NaClO3三种溶质。下列判断不正确的是
A.反应过程中消耗氯气与NaOH的物质的量之比为1:2
B.反应停止后n(NaClO):n(NaCl):n(NaClO3)可能为1:11:2
C.若反应过程中消耗lmol氯气,则1mol<转移电子<![]() mol
mol
D.溶液中c(Na+)和c(Cl-)之比可能为5:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖颁布给了三位为锂电池发展作出重要贡献的科学家,磷酸铁锂离子电池充电时阳极反应式为LiFePO4-xLi+-xe-→xFePO4+(1-x)LiFePO4。放电工作原理示意图如图。下列说法不正确的是
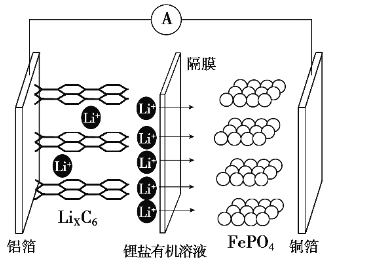
A.放电时,Li+通过隔膜移向正极
B.放电时,电子由铝箔沿导线流向铜箔
C.放电时正极反应为FePO4+xLi++xe-→xLiFePO4+(1-x)FePO4
D.磷酸铁锂离子电池充电过程通过Li+迁移实现,C、Fe、P元素化合价均不发生变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com