
| Na2O2/mol | NaHCO3/mol | 剩余固体成分 | |
| A | 1 | 2 | Na2CO3 |
| B | 1.5 | 2 | Na2O2Na2CO3 |
| C | 2 | 1 | Na2CO3、NaOH、Na2O2 |
| D | 2 | 2 | NaOH、Na2CO3 |
| A. | A | B. | B | C. | C | D. | D |
分析 混合物在密闭容器中加热,可能发生如下反应:
①2NaHCO3 $\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2,
②2Na2O2+2CO2═2Na2CO3+O2,
③2Na2O2+2H2O═4NaOH+O2,
④2NaOH+CO2═Na2CO3+H2O,
由上述反应,可得总的反应方程式为:
Ⅰ、Na2O2+2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$2Na2CO3+$\frac{1}{2}$O2↑+H2O↑
Ⅱ、2Na2O2+2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$2Na2CO3+O2↑+2NaOH
当n(Na2O2):n(NaHCO3)=1:2,只发生反应Ⅰ,且二者恰好完全反应,此时剩余固体为Na2CO3;
当n(Na2O2):n(NaHCO3)=2:2,只发生反应Ⅱ,且二者恰好完全反应,此时剩余固体为Na2CO3、NaOH;
当1:2<n(Na2O2):n(NaHCO3)<2:2,发生反应Ⅰ、Ⅱ,此时剩余固体为Na2CO3、NaOH;
当n(Na2O2):n(NaHCO3)<1:2,发生反应Ⅰ后碳酸氢钠有剩余,剩余的碳酸氢钠进行分解,此时剩余固体为Na2CO3;
当n(Na2O2):n(NaHCO3)>2:2,发生反应Ⅱ后过氧化钠有剩余,此时剩余固体为Na2O2、Na2CO3、NaOH.
解答 解:混合物在密闭容器中加热,可能发生如下反应:
①2NaHCO3 $\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2,
②2Na2O2+2CO2═2Na2CO3+O2,
③2Na2O2+2H2O═4NaOH+O2,
④2NaOH+CO2═Na2CO3+H2O,
由上述反应,可得总的反应方程式为:
Ⅰ、Na2O2+2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$2Na2CO3+$\frac{1}{2}$O2↑+H2O↑
Ⅱ、2Na2O2+2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$2Na2CO3+O2↑+2NaOH
A.n(Na2O2):n(NaHCO3)=1:2,只发生反应Ⅰ,且二者恰好完全反应,此时剩余固体为Na2CO3,故A正确;
B.1:2<n(Na2O2):n(NaHCO3)=3:4<2:2,发生反应Ⅰ、Ⅱ,此时剩余固体为Na2CO3、NaOH,故B错误;
C.n(Na2O2):n(NaHCO3)=2:1>2:2,发生反应Ⅱ后过氧化钠有剩余,此时剩余固体为Na2O2、Na2CO3、NaOH,故C正确;
D.n(Na2O2):n(NaHCO3)=2:2,只发生反应Ⅱ,且二者恰好完全反应,此时剩余固体为Na2CO3、NaOH,故D正确,
故选:B.
点评 本题考查混合物的有关计算等,难度较大,注意利用总反应方程式分段讨论,由于二氧化碳与氢氧化钠反应,故可以认为过氧化钠先与二氧化碳反应,反应完毕过氧化钠有剩余再与水反应,据此分段书写总反应式.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 只有①② | B. | 只有②③ | C. | 全部 | D. | 只有③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
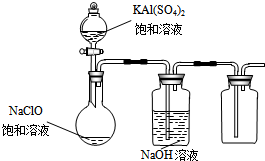 NaClO和KAl(SO4)2都是重要的化工产品,均可应用于造纸业.
NaClO和KAl(SO4)2都是重要的化工产品,均可应用于造纸业.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHSO4在熔融状态下的电离方程式为NaHSO4═Na++H++SO42- | |
| B. | H2CO3是弱酸,故Na2CO3是弱电解质 | |
| C. | Fe3O4俗称铁红,常用作红色油漆和涂料 | |
| D. | 2.4 g Mg无论与O2还是与N2完全反应转移的电子数均为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化钡溶液与稀硫酸反应 SO42-+Ba2+═BaSO4↓ | |
| B. | 氢氧化钠溶液与稀硫酸反应 OH-+H+═H2O | |
| C. | 铁与氯化铁溶液反应 Fe+Fe3+═2Fe2+ | |
| D. | 碳酸钙溶于稀盐酸中 CO32-+2H+═H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | M与X可形成两种常见的共价化合物,与W可形成两种常见的离子化合物 | |
| B. | Y的氢化物的沸点低于Z的氢化物的沸点 | |
| C. | Z的氢化物结合H+的能力强于M的氢化物结合H+的能力 | |
| D. | Z、M、W形成的简单离子,其半径大小W>Z>M |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | B的氢化物和E的氢化物能相互反应,且得到的产物只含有共价键 | |
| B. | C在元素周期表中的位置是第三周期第ⅠA族 | |
| C. | 金属D能在A的最高价氧化物中燃烧,生成A的化合物 | |
| D. | E单质的水溶液使紫色石蕊试液先变红后褪色,说明E单质具有漂白性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锌与镁 | B. | 铁与锌 | C. | 铝与铁 | D. | 镁与铁 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,33.6LHF中含有氟原子的数目为1.5NA | |
| B. | 17g-OH中电子数为9NA | |
| C. | 氢氧燃料电池正极消耗22.4 L气体时,电路中通过的电子数目为2NA | |
| D. | 标准状况下,0.1mol Cl2溶于水,转移电子数为0.1NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com