
【题目】化学中常用图像直观地描述化学反应的进程或结果。只改变一个条件,则下列对图像的解读正确的是
①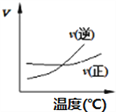 ②
②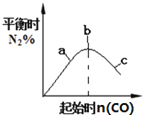 ③
③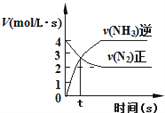 ④
④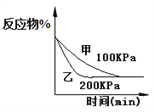
A. A2(g)+3B2(g)![]() 2AB3(g),如图①说明此反应的正反应是吸热反应
2AB3(g),如图①说明此反应的正反应是吸热反应
B. 4CO(g)+2NO2(g)![]() N2(g)+4CO2(g),如图②说明NO2的转化率b>a>c
N2(g)+4CO2(g),如图②说明NO2的转化率b>a>c
C. N2(g)+3H2(g)![]() 2NH3(g),如图③说明t秒时合成氨反应达到平衡
2NH3(g),如图③说明t秒时合成氨反应达到平衡
D. 2A(g)+2B(g)![]() 3C(g)+D(?),如图④说明生成物D一定是气体
3C(g)+D(?),如图④说明生成物D一定是气体
 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案科目:高中化学 来源: 题型:
【题目】常温下用0.1000mol/L的盐酸分别逐滴加入到20.00mL0.1000mol/L的三种一元碱XOH、MOH、YOH溶液中,溶液的pH随加入盐酸体积的变化如图所示。下列叙述错误的是
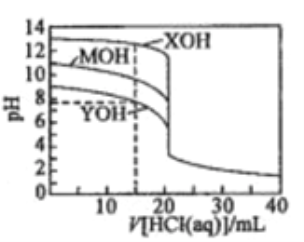
A. XOH为强碱,MOH、YOH均为弱碱
B. V[HCl(aq)]=15.00mL时,三种溶液中离子总浓度大小顺序:XOH>MOH>YOH
C. V[HCl(aq)]=20.00mL时,三种溶液中水的电离程度:XOH>MOH>YOH
D. V[HCl(aq)]=40.00ml.时,YOH溶液中:c(H+)=c(Y+)+c(OH-)+2c(YOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是常温下,浓度为0.01mol/L的NaOH溶液与几种酸或盐混合后的情况:
混合组别 | 混合前酸或盐的总浓度 | 混合比例及混合溶液性质 |
① | c(HA)=0.02mol/L | 等体积混合,pH>7 |
② | HB溶液的pH=2 | V1mLNaOH溶液与V2mLHB溶液,pH=7 |
③ | c(H2C)=0.01mol/L | 等体积混合,pH>7 |
④ | c(NaHD)=0.01mol/L | 等体积混合,pH=7 |
回答下列问题:
(1)①组混合液中,HA、A-、Na+三种粒子浓度由大到小的顺序为________,若pH=8,则c(Na+)-c(A-)=________mol/L(填具体数字)。
(2)由②组混合液pH=7可推知,V1____V2。
(3)③组混合液中,pH>7的原因是______________________。
(4)0.01mol/LNaHD溶液中,水的电离度=_________。(已知:水的电离度=[已电离的水分子的个数/水分子总数]×100%)
(5)仅凭上述结果,一定能确定HA、HB、H2C、H2D四种酸中属于弱酸的是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】几种物质在酸性溶液中的还原性强弱顺序如下:SO2>I->Fe2+>H2O2。据此判断下列反应不能发生的是
A. 2Fe3++SO2+2H2O=2Fe2++SO![]() +4H+
+4H+
B. H2O2+H2SO4=SO2↑+O2↑+2H2O
C. SO2+I2+2H2O=H2SO4+2HI
D. 2Fe3++2I-=2Fe2++I2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z是短周期元素,W的一种同位素无中子,X的单质在空气中含量约占78%,Y的单质在空气中燃烧发出耀眼白光,Z的单质用于工业制漂白粉。下列说法错误的是
A. W和X形成的化合物中可能既存在极性键,又存在非极性键
B. 含氧酸的酸性Z一定大于X
C. 工业上采取电解熔融Y和Z化合物的方法冶炼Y
D. W和X的化合物与W和Z的化合物反应可产生白烟
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式错误的是
A. 盐酸与烧碱溶液反应:H++OH-===H2O
B. 澄清石灰水中通入CO2变浑浊:CO2+Ca2++2OH-===CaCO3↓+H2O
C. 向氯化铝溶液中加入足量氨水:Al3++3OH-===Al(OH)3↓
D. Cl2与水反应生成盐酸和次氯酸:Cl2+H2O![]() H++Cl-+HClO
H++Cl-+HClO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学探究小组设计实验探究某种氮的化合物的制备及性质。
【探究一】下图A为某气体制备装置,图中未画出。
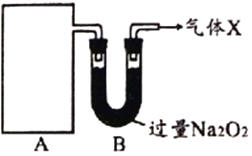
据此回答:
(1)①只用一种试剂制备A中某气体,选取的试剂是____________。
a.NH4HCO3 b.NH4Cl c.Ca(OH)2 d.NH4NO3
②装置A所用的主要玻璃仪器是____________(填仪器名称)。
(2)从装置A进入装置B的物质在B中被充分吸收,写出B中发生反应的化学方程式_______________________________(写出一个即可)。
【探究二】为探究上述装置中产生的气体性质,该化学探究小组又组装了如下装置,其中C处硬质试管中装有红色粉末铜粉。
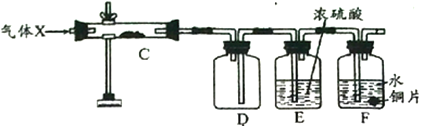
用酒精灯加热C处硬质试管一段时间后,再通入上述实验产生的气体,过一会撤去C处酒精灯。
据此回答:
(3)若实验过程中发现F处铜片逐渐溶解。则:
①D中观察到的现象是________________________________。
②C中发生反应的化学方程式为________________________________。
③F处铜片逐渐溶解的原因是________________________________。
④该装置的不足之处是________________________________。
(4)若实验过程中F处铜片没有任何变化,D中无任何现象发生,只观察到C中粉末在红色和黑色间交替变化。则C中发生反应的化学方程式为________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】党的十八大以来,我国在科技创新和重大工程建设方面取得了丰硕成果,在新时代更需要新科技创新世界。2018年3月5日,《自然》连刊两文报道石墨烯超导重大发现,第一作者均为中国科大10级少年班现年仅21岁的曹原。曹原团队在双层石墨烯中发现新的电子态,可以简单实现绝缘体到超导体的转变。石墨烯是一种由碳原子组成六角形呈蜂巢晶格的二维碳纳米材料(如图甲),石墨烯中部分碳原子被氧化后,其平面结构会发生改变,转化为氧化石墨烯(如图乙)。
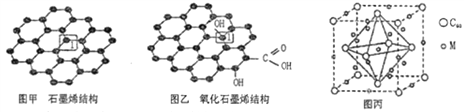
(1)图甲中,1号C与相邻C形成σ键的个数为__________。
(2)图乙中,1号C的杂化方式是__________,该C与相邻C形成的键角__________(填“>”、“<”或“=”)图甲中1号C与相邻C形成的键角。
(3)我国制墨工艺是将50nm左右的石墨烯或氧化石墨烯溶于水,在相同条件下所得到的分散系后者更为稳定,其原因是____________________。
(4)石墨烯可转化为富勒烯(C60),某金属M与C60可制备一种低温超导材料,晶胞如图丙所示,M原子位于晶胞的棱心与内部。该晶胞中M原子的个数为____________,该材料的化学式为_______________。
(5)金刚石与石墨都是碳的同素异形体。若碳原子半径为r,金刚石晶胞的边长为a,根据硬球接触模型,金刚石晶胞中碳原子的空间占有率为___________。
(6)一定条件下,CH4、CO2都能与H2O形成笼状结构(如下图所示)的水合物晶体,其相关参数见下表。CH4与H2O形成的水合物晶体俗称“可燃冰”。
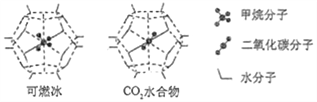
①“可燃冰”中分子间存在的2种作用力是___________________________;
②为开采深海海底的“可燃冰",有科学家提出用CO2置换CH4的设想。已知上图中笼状结构的空腔直径为0.586nm,结合图表从物质结构及性质的角度分析,该设想的依据是:___________________。
参数 分子 | 分子直径/nm | 分子与H2O的结合能E/(kJ·mol-1) |
CH4 | 0.436 | 16.40 |
CO2 | 0.512 | 29.91 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com