
科目:高中化学 来源: 题型:
下列对有机物结构或性质的描述中错误的是( )
A.将溴水加入苯中,溴水的颜色变浅,这是由于发生了加成反应
B.苯分子中的6个碳原子之间的键完全相同,是一种介于碳碳单键和碳碳双键之间的独特的键
C.乙烷和丙烯的物质的量共1 mol,完全燃烧生成3 mol H2O
D.一定条件下,Cl2可在甲苯的苯环或侧链上发生取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
氢化亚铜(CuH)是一种不稳定物质,能在氯气中燃烧,也能与酸反应。用CuSO4溶液和“某物质”在40~50 ℃时反应可产生它。下列有关叙述中错误的是( )
A.“某物质”具有还原性
B.CuH与盐酸反应,可能产生H2
C.CuH与足量的稀硝酸反应:CuH+3H++NO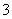 ===Cu2++NO↑+2H2O
===Cu2++NO↑+2H2O
D.CuH在氯气中燃烧:CuH+Cl2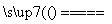 CuCl+HCl
CuCl+HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学实验室产生的废液中含有Fe3+、Cu2+、Ba2+、Cl-四种离子,现设计下列方案对废液进行处理,以回收金属并制备氯化钡、氯化铁晶体。

(1)沉淀1中含有的金属单质是__________。
(2)氧化时加入H2O2溶液发生反应的离子方程式为
________________________________________________________________________。
(3)下列物质中,可以作为试剂X的是__________(填字母)。
A.BaCl2 B.BaCO3
C.NaOH D.Ba(OH)2
(4)检验沉淀2洗涤是否完全的方法是__________。
(5)制备氯化铁晶体过程中需保持盐酸过量,其目的是__________。
(6)由过滤2得到的滤液制备BaCl2的实验操作依次为__________、冷却结晶、__________、洗涤、干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
过氧化钙可以用于改善地表水质,处理含重金属粒子废水和治理赤潮,也可用于应急供氧等。工业上生产过氧化钙的主要流程如下:
 CaCl2固体 30%的H2O2
CaCl2固体 30%的H2O2











NH3 副产品 产品
已知CaO2·8H2O呈白色,微溶于水,加热至350 ℃左右开始分解放出氧气。
(1)用上述方法制取CaO2·8H2O的化学方程式是________________________________________________________________________
________________________________________________________________________。
(2)检验“水洗”是否合格的方法是________。
(3)沉淀时常用冰水控制温度在0 ℃左右,其可能原因是(写出两种):
①________________________________________________________________________;
②________________________________________________________________________。
(4)测定产品中CaO2含量的实验步骤:
第一步:准确称取a g产品于有塞锥形瓶中,加入适量蒸馏水和过量的b g KI晶体,再滴入少量2 mol·L-1的H2SO4溶液,充分反应。
第二步:向上述锥形瓶中加入几滴淀粉溶液。
第三步:逐滴加入浓度为c mol·L-1的Na2S2O3溶液至反应完全,消耗Na2S2O3溶液V mL。
(已知:I2+2S2O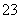 ===2I-+S4O
===2I-+S4O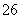 )
)
①CaO2的质量分数为____________(用字母表示);
②某同学第一步和第二步的操作都很规范,第三步滴速太慢,这样测得的CaO2的质量分数可能________(填“不受影响”、“偏低”或“偏高”),原因是________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知1 g氢气完全燃烧生成水蒸气时放出热量 121 kJ,且氧气中1 mol O===O键完全断裂时吸收热量496 kJ,水蒸气中1 mol H—O键形成时放出热量463 kJ,则氢气中1 mol H—H键断裂时吸收热量为( )
A.920 kJ B.557 kJ
C.436 kJ D.188 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
碳、硫的含量影响钢铁性能,碳、硫含量的一种测定方法是将钢样中碳、硫转化为气体,再用测碳、测硫装置进行测定。
(1)采用装置A,在高温下将x克钢样中碳、硫转化为CO2、SO2。
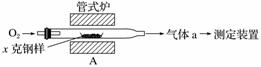
①气体a的成分是________________。
②若钢样中硫以FeS形式存在,A中反应:3FeS+5O2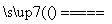
1________+3________。
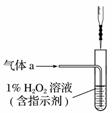
(2)将气体a通入测硫装置中(如右图),采用滴定法测定硫的含量。
①H2O2氧化SO2的化学方程式
________________________________________________________________________
________________________________________________________________________。
②用NaOH溶液滴定生成的H2SO4,消耗z mL NaOH溶液,若消耗1 mL NaOH溶液相当于硫的质量为y克,则该钢样中硫的质量分数:________。
(3)将气体a通入测碳装置中(如下图),采用重量法测定碳的含量。
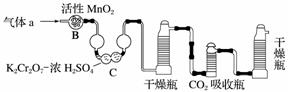
①气体a通过B和C的目的是__________________________________________。
②计算钢样中碳的质量分数,应测量的数据是________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
用惰性电极电解一定浓度的CuSO4溶液,通电一段时间后,向所得的溶液中加入
0.1 mol Cu(OH)2后恰好恢复到电解前的浓度和pH。则下列说法正确的是( )
A.电解过程中阴极没有气体生成
B.电解过程中转移的电子的物质的量为0.4 mol
C.原CuSO4溶液的浓度为0.1 mol·L-1
D.电解过程中阳极收集到的气体体积为2.24 L(标况下)
查看答案和解析>>
科目:高中化学 来源: 题型:
如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
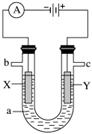
(1)若X、Y是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞,则:
①电解池中X极上的电极反应式是____________________________________________,
在X极附近观察到的现象是_________________________________________________。
②Y电极上的电极反应式是_______________________________________,
检验该电极反应产物的方法是____________________________________________。
(2)若用电解方法精炼粗铜,电解液a选用CuSO4溶液,则:
①X电极的材料是________________________________________,
电极反应式是__________________________________________。
②Y电极的材料是__________________________________________,
电极反应式是________________________________________________
(说明:杂质发生的电极反应不必写出)。
③当电路中有0.04 mol电子通过时,阴极增重_____________________________ g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com