
分析 (1)钠和水反应生成氢氧化钠和氢气;
(2)过氧化钠和二氧化碳、水反应生成氧气,根据化合价代数和为0,判断化合价;
(3)碳酸氢钠不稳定,加热易分解生成碳酸钠.
解答 解:(1)钠和水反应方程式为:2Na+2H2O=2NaOH+H2↑,
故答案为:氢氧化钠、氢气;
(2)过氧化钠和水、二氧化碳反应方程式为:2Na2O2+2H2O=4NaOH+O2↑、2N2O2+2CO2=2Na2CO3+O2↑,氧化钠和水、二氧化碳反应都不生成氧气,
过氧化钠中氧元素的化合价为-1,故答案为:过氧化钠;-1;
(3)碳酸钠较稳定,碳酸氢钠不稳定,加热条件下易分解生成碳酸钠,2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,所以采用加热的方法除去碳酸氢钠,
故答案为:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O.
点评 本题以钠及其化合物为载体考查了除杂、物质的用途等知识点,根据物质的性质来分析解答即可,明确物质的性质是解本题关键,题目难度不大.


科目:高中化学 来源: 题型:解答题
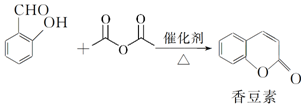

 ;
; 和
和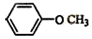 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若忽略水的电离及H2CO3的第二级电离,则H2CO3?HCO3-+H+的平衡常数K1=4.2×10-7 | |
| B. | 少量Cl2通入到过量的Na2CO3溶液的离子方程式为Cl2+2CO32-+H2O═2HCO3-+Cl-+ClO- | |
| C. | Cl2与Na2CO3按物质的量之比1:1恰好反应的离子方程式为Cl2+CO32-+H2O═HCO3-+Cl-+HClO | |
| D. | 少量CO2通入到过量的NaClO溶液的离子方程式为2ClO-+CO2+H2O═CO32-+2HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 滴定次数 | 待测氢氧化钠溶液的体积/mL | 0.1000mol/L盐酸的体积(mL) | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体/mL | ||
| 第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
| 第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 滴定次数 | 待测液体积(mL) | 标准硫酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 20.00 | 0.50 | 25.45 |
| 第二次 | 20.00 | 4.00 | 29.05 |
| 第三次 | 20.00 | 3.00 | 30.00 |
| 第四次 | 20.00 | 2.00 | 27.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正反应是放热反应的可逆反应,升高温度v(正)>v(逆) | |
| B. | 加压可使速率加快,是因为增加活化分子百分数而使反应速率加快 | |
| C. | 活化分子的碰撞不一定都能发生化学反应 | |
| D. | 催化剂可改变反应进程,故加催化剂改变了一个反应的△H |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两种气体的物质的量相等 | B. | O2比O3的质量小 | ||
| C. | 两种气体的分子数目相等 | D. | 两种气体中的氧原子数目相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 N2O4(g)已达平衡状态,因反应是放热反应,放置时气体温度下降,平衡向正反应方向移动,NO2浓度降低.[已知2NO2(g)?N2O4(g)在几微秒内即可达到化学平衡].
N2O4(g)已达平衡状态,因反应是放热反应,放置时气体温度下降,平衡向正反应方向移动,NO2浓度降低.[已知2NO2(g)?N2O4(g)在几微秒内即可达到化学平衡].查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com