
| 生成物浓度系数幂次方 |
| 反应物浓度系数幂次方 |
| ||
| 生成物浓度系数幂次方 |
| 反应物浓度系数幂次方 |
| [NO]4?[H2O]6 |
| [NH4]?[O2]5 |
| [NO]4?[H2O]6 |
| [NH4]?[O2]5 |


科目:高中化学 来源: 题型:
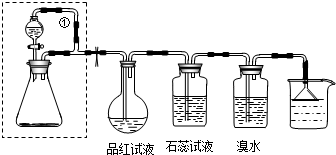
查看答案和解析>>
科目:高中化学 来源: 题型:
| 步骤 | 操作 | 现象 |
| ① | 用pH试纸检验 | 溶液的pH大于7 |
| ② | 向溶液中滴加氯水,再加入CCl4振荡,静置 | CCl4层呈紫红色 |
| ③ | 向所得水溶液中加入Ba(NO3)2溶液和稀HNO3 | 有白色沉淀产生 |
| ④ | 过滤,向滤液中加入AgNO3溶液和稀HNO3 | 有白色沉淀产生 |
| A、肯定含有的离子是③④⑤ |
| B、肯定没有的离子是②⑤ |
| C、不能确定的离子是③⑥ |
| D、可能含有的离子是①⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙醇和丙三醇互为同系物 |
| B、16gCH4和18gNH4+所含的质子数相等 |
| C、32S和33S的核外电子数相等,属于同一种核素 |
| D、质量相等,体积不等的CO和C2H4的分子数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、甲烷、苯、乙醇和乙酸在一定条件下都能发生取代反应 |
| B、乙烯使酸性高锰酸钾溶液和溴的四氯化碳溶液褪色的反应类型不同 |
| C、塑料、合成橡胶、合成纤维都属于合成有机高分子材料 |
| D、化学式均为(C6H10O5)n的淀粉和纤维素互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaI和NaIO3在一定条件下能反应生成I2 |
| B、I2在反应①中是还原产物,在反应②中是氧化产物 |
| C、两个反应中生成等量的I2时转移电子数相等 |
| D、氧化性:Mn02>SO42->I03->I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe(NO3)3加入过量的HI溶液:2Fe3++2I-═2Fe2++I2 |
| B、硫酸镁溶液与氢氧化钡溶液混合:SO42-+Ba2+═BaSO4↓ |
| C、等体积等物质的量浓度的NaHCO3溶液与Ba(OH)2溶液混合:HCO3-+Ba2++OH-═BaCO3↓+H2O |
| D、Cu溶于足量稀硝酸:Cu+2NO3-+4H+═Cu2++2NO2↑+2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com