
| 配料 | 氯化钠、碘酸钾 |
| 含碘量 | 20~30mg/1Kg |
| 保质期 | 18个月 |
| 食用方法 | 勿长时间炖炒 |
| 贮藏指南 | 避热、避光、密封、防潮 |


科目:高中化学 来源: 题型:
| A、室温下,在水中的溶解度:丙三醇>苯酚>1-氯丁烷 |
| B、用核磁共振氢谱不能区分HCOOCH3和HCOOCH2CH3 |
| C、用Na2CO3溶液不能区分CH3COOH和CH3COOCH2CH3 |
| D、油脂在酸性或碱性条件下均可发生水解反应,且产物相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
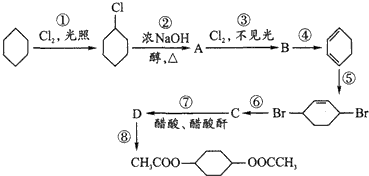
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
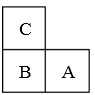 如图所示:A、B、C是短周期的三种相邻元素.A、B同周期,B、C同主族;这三种元素的质子数之和为38;最外层电子数之和为16.则它们的元素符号分别为:A
如图所示:A、B、C是短周期的三种相邻元素.A、B同周期,B、C同主族;这三种元素的质子数之和为38;最外层电子数之和为16.则它们的元素符号分别为:A查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com