
| 元素编号 | 元素性质与原子(或分子)结构 | |
| T | 最外层电子数是次外层电子数的3倍 | |
| X | 常温下单质为双原子分子,分子中含有3对共用电子对 | |
| Y | M层比K层少1个电子 | |
| Z | 第三周期元素的简单离子中半径最小 | |
| W | W带两个负电荷的阴离子与Ar具有相同电子层结构 | |
 .
. .
.分析 T元素原子最外层电子数是次外层电子数的3倍,原子只能有2个电子层,最外层电子数为6,则T为O元素;
常温下X的单质为双原子分子,分子中含有3对共用电子对,则X为N元素;
Y元素原子M层比K层少1个电子,则M层的电子数为1,Y为Na;
第三周期元素的简单离子中Z的半径最小,则Z为Al,
W带两个负电荷的阴离子与Ar具有相同电子层结构,则W的质子数为18-2=16,然后结合元素化合物知识来解答.
解答 解:T元素原子最外层电子数是次外层电子数的3倍,原子只能有2个电子层,最外层电子数为6,则T为O元素;
常温下X的单质为双原子分子,分子中含有3对共用电子对,则X为N元素;
Y元素原子M层比K层少1个电子,则M层的电子数为1,Y为Na;
第三周期元素的简单离子中Z的半径最小,则Z为Al,
W带两个负电荷的阴离子与Ar具有相同电子层结构,则W的质子数为18-2=16,
(1)T为O,原子结构示意图为 ,故答案为:
,故答案为: ;
;
(2)Na、Al同周期,随原子序数增大,金属性减弱,故Na的金属性较强
a.单质的熔点属于物理性质,不能比较金属性强弱,故a错误;
b.Y的化合价比Z低,金属性强弱与失去电子难易有关,与失去电子数目多少无关,即与化合价高低无关,故b错误;
c.Na单质与水反应比Al单质剧烈,说明Na金属性更强,故c正确;
d.Na最高价氧化物的水化物的碱性比Al强,说明钠的金属性更强,故d正确;
故答案为:Na;cd;
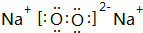
(3)O、N、Na、Al中有两种元素能形成既有离子键又有共价键的化合物,该化合物为Na2O2,其电子式为 ,
,
故答案为: ;
;
(4)O元素和氢元素可形成一种18电子的化合物Q为H2O2,N元素与氢元素也能按原子个数比为1:2形成一种18电子化合物W为N2H4,H2O2与N2H4发生氧化还原反应,生成氮气与水,该反应的化学方程式为N2H4+2H2O2═N2↑+4H2O,
故答案为:N2H4+2H2O2═N2↑+4H2O;
(5)当亚硫酸钠滴入盐酸中时发生SO32-+2H+═H2O+SO2↑,
当盐酸滴入亚硫酸钠溶液时,反应顺序为SO32-+H+═HSO3-、HSO3-+H+═H2O+SO2↑,则HCl的物质的量应大于Na2SO3的物质的量,又因为最终生成的气体体积不同,
则HSO3-+H+=H2O+SO2不能全部完成,即HCl的物质的量比Na2SO3的物质的量的二倍少,
亚硫酸钠的物质的量为0.2mol,
则HCl的物质的量应介于0.2mol~0.4mol之间,
盐酸溶液的体积为200mL=0.2L,
即盐酸的浓度应该是大于1mol/L,小于2mol/L.
故答案为:B.
点评 本题考查位置、结构与性质的关系及应用,为高频考点,把握元素的位置、元素的推断及元素化合物知识为解答的关键,(5)为解答的难点,注意反应的先后顺序,题目难度中等.


 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案科目:高中化学 来源: 题型:解答题
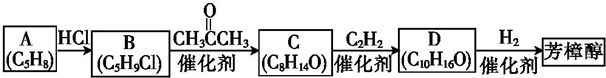
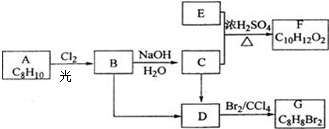
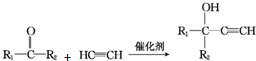 (R1、R2均为烃基)
(R1、R2均为烃基) ,该反应类型为加成反应.
,该反应类型为加成反应.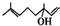 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤 | 1.将一小块金属钠放入滴有酚酞溶液的冷水中; 2.将一小段用砂纸打磨后的镁带放入试管中,加入少量水,加热至水沸腾,冷却后,向试管中滴加酚酞溶液; 3.将一小段镁带投入稀盐酸中; 4.将一小片铝投入稀盐酸中. |
| 实验现象 | A.剧烈反应,迅速生成大量的气体 B.浮在水面上,熔成小球,不断游动,小球渐小最终消失,溶液变红 C.反应不剧烈,产生无色气体 D.有气体产生,溶液变成红色 |
| 实验步骤 | 1 | 2 | 3 | 4 |
| 实验现象 | B | D | A | C |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

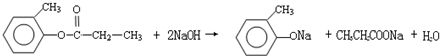
 +NaOH$→_{△}^{醇}$
+NaOH$→_{△}^{醇}$ +NaCl+H2O
+NaCl+H2O
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质子数:c>d | B. | 原子半径:X<W | ||
| C. | 氢化物的稳定性:H2Y>HZ | D. | 离子的还原性:Y2->Z- |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 选项 | 含杂质的物质 | 试剂 | 除杂方法 |
| A | C2H4(SO2) | NaOH溶液 | 洗气 |
| B | C6H6(Br2) | Fe粉 | 蒸馏 |
| C | C6H5NO2(HNO3) | NaOH溶液 | 分液 |
| D | C2H6(C2H4) | 酸性KMnO4溶液 | 洗气 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑥ | B. | ②④⑤ | C. | ①②⑦ | D. | ④⑤⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+、Na+、Cl-、OH- | B. | Fe2+、H+、NO3-、SO42- | ||
| C. | NH4+、K+、HCO3-、OH- | D. | Fe3+、NH4+、NO3-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题


 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com