
【题目】一定温度下,在—定体积的密闭容器中,下列叙述能作为可逆反应A(S)+2B(g) ![]() C(g) +D (g)达到平衡状态标志的是
C(g) +D (g)达到平衡状态标志的是
A. 混合气题的平均分子量不再变化 B. 单位时间内消耗2a mol B,同时生成amol C
C. 2v正(B)=v逆(C) D. 混合气体的总压强不再变化
科目:高中化学 来源: 题型:
【题目】下列离子在溶液中因发生氧化还原反应而不能大量共存的是
A.H+、NO3-、Fe2+、Na+ B.Ag+、K+、I-、Cl-
C.K+、Ba2+、OH-、SO42- D.K+、Cu2+、Br-、OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质按纯净物、混合物、强电解质和非电解质顺序排列的是( )
A. 单甘油酯、混甘油酯、苛性钾、H2S、
B. 胆矾、漂白粉、硫酸钠、次氯酸
C. 明矾、水煤气、盐酸、铜
D. 冰醋酸、福尔马林、硫酸钡、乙醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 含氧元素的化合物就一定是氧化物
B. 由不同种元素组成的纯净物就是化合物
C. 溶于水后得到的溶液能导电的物质是电解质
D. 只含有一种元素的物质不可能是混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以某含铜矿石[主要成分为FeCu4SiO5(OH)4,含少量SiO2、CuCO3]为原料,制备CuSO4·5H2O的流程如下:
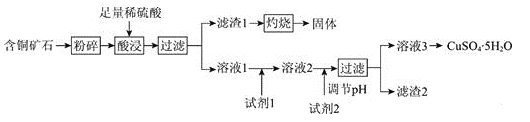
已知:
ⅰ.溶液中离子浓度小于等于1.0×10-5mol·L-1时,认为该离子沉淀完全。
ⅱ.相关试剂成分和价格如表1所示。
ⅲ.25℃时,该流程中金属离子生成氢氧化物时,开始沉淀和沉淀完全的pH如表2所示。
表1
试剂 | 成分 | 价格/(元·吨-1) |
漂白液 | 含25.2%NaClO | 450 |
双氧水 | 含30%H2O2 | 2400 |
浓硝酸 | 含98%HNO3 | 1500 |
表2
氢氧化物 | 开始沉淀的pH | 沉淀完全的pH |
Fe(OH)2 | 7.6 | 9.6 |
Fe(OH)3 | 2.7 | 3.7 |
Cu(OH)2 | 4.0 | 6.5 |
请回答:
(1)FeCu4SiO5(OH)4用氧化物的形式可表示为________。
(2)结合题中信息,所选用的试剂1的名称为________;加入该试剂时,所发生反应的离子方程式为________。
(3)加入试剂2,需调节溶液的pH的合理范围为________。试剂2可以选择下列物质中的________(填字母)。
A.Cu B.CuO
C.Cu(OH)2 D.Fe
(4)25℃时,Cu(OH)2的溶度积常数Ksp[Cu(OH)2]=________。
(5)CuSO4·5H2O溶液可用于电解精炼铜。电解精炼铜时,导线中通过9.632×104C的电量时,理论上阴极质量增加________g。(已知:1个电子的电量为1.6×10-19C)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知M2O7x-+3S2-+14H+=2M3++3S↓+7H2O,则M2O7x-中的M的化合价为
A.+2价 B.+3价 C.+4价 D.+6价
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com