
【题目】下列表示物质结构的化学用语或说法中,正确的是( )
A.中子数为8的氮原子:8N
B.次氯酸的电子式: ![]()
C.PCl5分子的每个原子都满足8电子稳定结构
D.用电子式表示NaCl的形成过程: ![]()
科目:高中化学 来源: 题型:
【题目】如表中评价合理的是( )
选项 | 化学反应及其离子方程式 | 评价 |
A | 铁与稀盐酸反应: | 正确 |
B | 大理石溶于醋酸的反应: | 错误,醋酸应写为分子形式CH3COOH,CaCO3应写成离子形式 |
C | FeCl3溶液“腐蚀”铜箔: | 正确 |
D | NH4HCO3溶液与过量NaOH浓溶液共热:NH4++OH﹣ | 错误,HCO3﹣也可以与OH﹣反应 |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组同学模拟工业制碘的方法,探究ClO3﹣和I﹣的反应规律.实验操作及现象如表:
实验及试剂 | 编号 | 无色NaClO3 | 试管中 | 淀粉KI |
| 1 | 0.05 mL | 浅黄色 | 无色 |
2 | 0.20 mL | 深黄色 | 无色 | |
3 | 0.25 mL | 浅黄色 | 蓝色 | |
4 | 0.30 mL | 无色 | 蓝色 |
(1)取实验2后的溶液,进行如图实验: 
经检验,上述白色沉淀是AgCl.写出加入0.20mL NaClO3后,溶液中ClO3﹣和I﹣发生反应的离子方程式: .
(2)查阅资料:一定条件下,I﹣和I2都可以被氧化成IO3﹣ .
作出假设:NaClO3溶液用量增加导致溶液褪色的原因是过量的NaClO3溶液与(1)
中的反应产物继续反应,同时生成Cl2 .
进行实验:
①取少量实验4中的无色溶液进行如图实验,进一步佐证其中含有IO3﹣ . 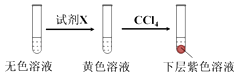
其中试剂X可以是(填字母序号).
a.碘水b.KMnO4溶液c.NaHSO3溶液
②有同学提出,仅通过湿润淀粉KI试纸变蓝的现象不能说明生成Cl2 , 便补充了如下实验:将实验4中的湿润淀粉KI试纸替换为湿润的淀粉试纸,再滴加0.30mL 1.33molL﹣1NaClO3溶液后,发现湿润的淀粉试纸没有明显变化.进行以上对比实验的目的是 , 进一步佐证实验4中生成了Cl2 . 获得结论:NaClO3溶液用量增加导致溶液褪色的原因是(用离子方程式表示).
(3)小组同学继续实验,通过改变实验4中硫酸溶液的用量,获得如表实验结果:
编号 | 6.0 molL﹣1 H2SO4溶液用量 | 试管中溶液颜色 | 淀粉KI试纸颜色 |
5 | 0.25 mL | 浅黄色 | 无色 |
6 | 0.85 mL | 无色 | 蓝色 |
①对比实验4和5,可以获得的结论是 .
②用离子方程式解释实验6的现象: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[实验化学]
焦亚硫酸钠(Na2S2O5)是常用的抗氧化剂,在空气中,受热时均易分解.实验室制备少量Na2S2O5的方法:在不断搅拌下,控制反应温度在40℃左右,向Na2CO3过饱和溶液中通入SO2 , 实验装置如图所示.当溶液pH约为4时,停止反应.在20℃静置结晶,生成Na2S2O5的化学方程式为:2NaHSO3═Na2S2O5+H2O.
(1)SO2与Na2CO3溶液反应生成NaHSO3和CO2 , 其离子方程式为 .
(2)装置Y的作用是 .
(3)析出固体的反应液经减压抽滤,洗涤,25℃﹣30℃干燥,可获得Na2S2O5固体.
①组成减压抽滤装置的主要仪器是布氏漏斗、和抽气泵.
②依次用饱和SO2水溶液、无水乙醇洗涤Na2S2O5固体,用饱和SO2水溶液洗涤的目的是 .
(4)实验制得的Na2S2O5固体中含有一定量的Na2SO3 和Na2SO4 , 其可能的原因是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuCl广泛应用于化工和印染等行业.某研究性学习小组拟热分解CuCl22H2O制备CuCl,并进行相关探究.
【资料查阅】
【实验探究】
该小组用如图所示装置进行实验(夹持仪器略).
请回答下列问题:
(1)仪器X的名称是 .
(2)实验操作的先后顺序是a→→e(填操作的编号)
a.检查装置的气密性后加入药品
b.熄灭酒精灯,冷却
c.在“气体入口”处通入干燥HCl
d.点燃酒精灯,加热
e.停止通入HCl,然后通入N2
(3)在实验过程中,观察到B中物质由白色变为蓝色,C中试纸的颜色变化是 .
(4)装置D中发生的氧化还原反应的离子方程式是 .
(5)【探究反思】
反应结束后,取出CuCl产品进行实验,发现其中含有少量的CuCl2或CuO杂质,根据资料信息分析:
①若杂质是CuCl2 , 则产生的原因是 .
②若杂质是CuO,则产生的原因是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤制天然气工艺是煤高效洁净利用的新途径之一,其工艺流程简如图1如下:
(1)反应I:C(s)+H2O(g)CO(g)+H2(g)△H=+135kJmol﹣1 , 通入的氧气会与部分碳发生燃烧反应.请利用能量转化及平衡移动原理说明通入氧气的作用: .
(2)反应II:CO(g)+H2O(g)CO2(g)+H2(g)△H=﹣41kJmol﹣1 . 如图2表示不同温度条件下,煤气化反应I发生后的汽气比(水蒸气与原料气中CO物质的量之比)与CO平衡转化率的变化关系.
①判断T1、T2和T3的大小关系: .
②若煤气化反应I发生后的汽气比为0.8,经煤气化反应I和水气变换反应II后,得到CO与H2的物质的量之比为1:3,则反应II应选择的温度是(填“T1”“T2”或“T3”).
(3)①甲烷化反应IV发生之前需要进行脱酸反应III.煤经反应I和II后的气体中含有两种酸性气体,分别是H2S和 .
②工业上常用热碳酸钾法脱除H2S气体得到两种酸式盐,该反应的化学方程式是 .
(4)已知:
CO(g)+H2O(g)CO2(g)+H2(g)△H1=﹣41kJmol﹣1
2H2(g)+O2(g)2H2O(g)△H2=﹣484kJmol﹣1
CH4(g)+2O2(g)CO2(g)+2H2O(g)△H3=﹣802kJmol﹣1
反应IV:CO(g)+3H2(g)CH4(g)+H2O(g)△H=
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某冶炼厂利用炼铜产生的SO2生产硫酸,变废为宝,化害为利。其原理是
A. 利用了SO2的水溶性,将SO2直接通入水中
B. 利用了SO2的氧化性,将SO2直接通入水中
C. 利用了SO2的氧化性,使其与O2反应而转化为SO3,再与水反应
D. 利用了SO2的还原性,使其与O2反应而转化为SO3,再与水反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《天工开物》中记了砒霜的制取:“凡烧砒,下鞠土窑,纳石其上,上砌曲突,以铁釜倒悬履突口。其下灼炭举火,其烟气从曲突内熏贴釜上”。文中涉及的操作方法可用于( )
A.从石油中获得汽油
B.分离单质碘和氯化钠的固体混合物
C.苯甲酸的重结晶
D.从溴水中提取溴
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com