
【题目】下列说法正确的是( )
A. pH<7的溶液一定呈酸性
B. pH=5的H2S溶液中,c(H+)=c(HS-)=1×10-5mol/L
C. 盐碱地不利于作物生长,通过施加适量石膏可以降低土壤碱性
D. 在NaCl和NaBr的混合溶液中滴加AgNO3溶液,一定先产生淡黄色沉淀
【答案】C
【解析】A,25℃时pH![]() 7的溶液呈酸性,100℃时pH
7的溶液呈酸性,100℃时pH![]() 6的溶液呈酸性(100℃中性溶液的pH=6),由于没有温度限制pH
6的溶液呈酸性(100℃中性溶液的pH=6),由于没有温度限制pH![]() 7的溶液不一定呈酸性,A项错误;B,H2S属于二元弱酸,存在分步电离平衡:H2S
7的溶液不一定呈酸性,A项错误;B,H2S属于二元弱酸,存在分步电离平衡:H2S![]() H++HS-、HS-
H++HS-、HS-![]() H++S2-,pH=5的H2S溶液中c(H+)=1
H++S2-,pH=5的H2S溶液中c(H+)=1![]() 10-5mol/L,c(H+)
10-5mol/L,c(H+)![]() c(HS-),B项错误;C,盐碱地中含较多的NaCl、Na2CO3,由于CO32-的水解盐碱地呈碱性,施加适量石膏,CaSO4与Na2CO3反应生成CaCO3和Na2SO4,降低土壤碱性,C项正确;D,由于混合液中NaCl和NaBr的浓度未知,无法确定滴加AgNO3溶液后先达到AgCl的溶度积还是先达到AgBr的溶度积,所以不一定先产生淡黄色的AgBr沉淀,D项错误;答案选C。
c(HS-),B项错误;C,盐碱地中含较多的NaCl、Na2CO3,由于CO32-的水解盐碱地呈碱性,施加适量石膏,CaSO4与Na2CO3反应生成CaCO3和Na2SO4,降低土壤碱性,C项正确;D,由于混合液中NaCl和NaBr的浓度未知,无法确定滴加AgNO3溶液后先达到AgCl的溶度积还是先达到AgBr的溶度积,所以不一定先产生淡黄色的AgBr沉淀,D项错误;答案选C。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】500mLKNO3和Cu(NO3)2的混合溶液中c(NO3-)=0.6mol·L-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到2.24L气体(标准状况下),假定电解后溶液体积仍为500mL,下列说法正确的是
A. 上述电解过程中共转移0.2mol电子
B. 原混合溶液中c(K+)为0.2mol·L-1
C. 电解得到的Cu的物质的量为0.05mol
D. 电解后溶液中c(H+)为0.2mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组同学利用下图装置对电化学原理进行了一系列探究活动。

(1)甲池为装置_______(填“原电池”或“电解池”)。
(2)甲池反应前,两电极质量相等,一段时间后,两电极质量相差28g,导线中通过_________mol电子。
(3)实验过程中,甲池左侧烧杯中NO3-的浓度_______(填“变大”、“变小”或“不变”)。
(4)其他条件不变,若用U形铜棒代替“盐桥”,工作一段时间后取出铜棒称量,质量___________(填“变大”、“变小”或“不变”)。若乙池中的某盐溶液是足量AgNO3溶液,则乙池中左侧Pt电极反应式为___________________________________,工作一段时间后,若要使乙池溶液恢复原来浓度,可向溶液中加入_____________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一容积不变的密闭容器中充入一定量A(g)和B,发生反应:xA(g)+2B(s) ![]() yC(g) △H<0.在一定条件下,容器中A、C的物质的量浓度随时间变化的曲线如图所示。
yC(g) △H<0.在一定条件下,容器中A、C的物质的量浓度随时间变化的曲线如图所示。
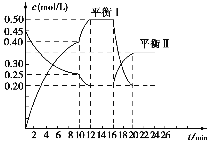
请回答下列问题
(1)根据图示可确定x:y=________。
(2)0-10min容器内压强______ (填“变大”、“ 不变”或“变小”)
(3)推测第10min引起曲线变化的反应条件可能是______(填编号,下同);第16min引起曲线变化的反应条件可能是________。
①减压 ② 增大A的浓度 ③增大C的量 ④升温 ⑤ 降温⑥ 加催化剂
(4)若平衡1的平衡常数为K1,平衡II的平衡常数为K2,则K1______(填“>”“=”或“<”)K2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生物体内某些有机物的元素组成可表示如下:

(1)A的功能的多样性是由A的_________的多样性决定的。字母A3代表的物质的名称是_________,产生A2 过程涉及的单层膜的细胞器有__________、_________。
(2)c的名称为______,C1的名称为_______; 人体内C彻底水解得到的产物有_________种。
(3)B是主要的能源物质,则b______________。
(4)A是由a经_______反应形成的,形成的化学键的结构简式是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙二酸(H2C2O4)俗称草酸,是二元弱酸。回答下列问题:
(1)在恒温、恒容密闭容器中发生反应:H2C2O4(s)![]() H2O(g)+CO(g)+CO2(g),下列描述能说明反应已经达到平衡状态的是____________(填标号)。
H2O(g)+CO(g)+CO2(g),下列描述能说明反应已经达到平衡状态的是____________(填标号)。
A.压强不再变化 B.CO2(g)的体积分数保持不变
C.混合气体密度不再变化 D.混合气体平均摩尔质量保持不变
(2)草酸溶液中各离子浓度分数δ(X)随溶液pH变化的关系如图所示:

①当溶液中含碳粒子的主要存在形态为C2O42-时,溶液的酸碱性为____________(填标号)。
A.强酸性 B.弱酸性 C.中性 D.碱性
②25℃时,反应C2O42-+H2C2O4-![]() 2HC2O4-的平衡常数的对数值1gK=____________。
2HC2O4-的平衡常数的对数值1gK=____________。
(3)向10mL0.1mol·L-1H2C2O4溶液中逐滴加入0.1mol·L-1NaOH溶液,当溶液中c(Na+)=2c(C2O42-)+c(HC2O4-)时,加入V(NaOH)____________10mL(填“>”“=”或“<”)。
(4)草酸晶体(H2C2O4·2H2O)为无色,某同学设计实验测定其纯度。实验过程如下:称取mg草酸晶体于试管中,加水完全溶解用cmol·L-1酸性KMnO4标准溶液进行滴定,则达到滴定终点时的现象是____________;该过程中发生反应的离子方程式为____________;滴定过程中消耗VmLKMnO4标准溶液,草酸晶体纯度为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】链烃A是重要的有机化工原料,由A经以下反应可制备一种有机玻璃:

已知:羰基化合物可发生以下反应:

(注:R'可以是烃基,也可以是H原子)
回答下列问题:
(1)A分子中官能团的结构简式为____________,分子结构鉴定时,获取官能团信息的仪器是____________。
(2)B生成C的反应类型为____________。
(3)核磁共振氢谱表明D只有一种化学环境的氢,D的结构简式为_________,分子中最多有_______个原子共平面。
(4)E发生酯化、脱水反应生成F的化学方程式为_____________________________。
(5)F的同分异构体中能同时满足下列条件的共有____________种(不含立体异构)。
①能与饱和NaHCO3溶液反应产生气体②能使Br2的四氯化碳溶液褪色
其中核磁共振氢谱显示为3组峰,且峰面积比为6∶1∶1的结构简式为____________。
(6)聚丙烯酸钠(![]() )是一种高吸水性树脂。参考上述信息,设计由乙醇制备该高聚物单体的合成线路。_______________________________________________________
)是一种高吸水性树脂。参考上述信息,设计由乙醇制备该高聚物单体的合成线路。_______________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在0.1mol·L-1NH3·H2O 溶液中有如下电离平衡:NH3·H2O ![]() NH4++OH- 对于该平衡,下列叙述正确的是
NH4++OH- 对于该平衡,下列叙述正确的是
A.加入水时,平衡向逆反应方向移动
B.加入少量NaOH固体,平衡向逆反应方向移动
C.加入少量 0.1 mol·L-1盐酸,溶液中c(H+)减小
D.加入少量NH4Cl固体,平衡向正反应方向移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com