已知反应:
①2K2CrO4+H2SO4═K2Gr2O7+K2SO4+H2O
②Fe2(SO4)3+2HI═2FeSO4+I2+H2SO4
③[]K2Cr2O7+[]FeSO4+[]H2SO4--[]Fe2(SO4)3+[]Cr2(SO4)3+[]K2SO4+[]H2O
(1)上速三个反应中,属于氧化还原反应的是______(填序号)
(2)在上述反应③上完成并配平该化学反应方程式,并标出电子转移的方向和数目.
(3)K2Cr2O7、I2、Fe3+三种微粒氧化性由强到弱的顺序:______.
【答案】
分析:(1)氧化还原反应的特征是有化合价的变化,有化合价变化的反应是氧化还原反应;
(2)氧化还原反应中,化合价升高元素失去电子,化合价降低元素得到电子,得失电子数相等即为反应转移电子数;
(3)氧化还原反应中,氧化剂的氧化性强于氧化产物的氧化性.
解答:解:(1)三个反应中,均存在元素化合价的变化,所以均属于氧化还原反应,故答案为:①②③;
(2)该氧化还原反应中,化合价升高的铁元素失去电子,化合价降低的铬元素得到电子,得失电子数相等为6,所以反应转移电子数为6,电子转移的方向和数目如下所示:
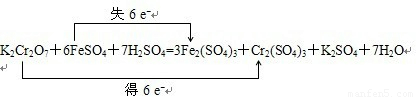
,故答案为:

;
(3)在③中氧化剂是K
2C
r2O
7,氧化产物是Fe
3+,所以氧化性:K
2C
r2O
7>Fe
3+,在②中,氧化剂是Fe
3+,氧化产物是I
2,所以氧化性:Fe
3+>I
2,综上,氧化性顺序为:K
2C
r2O
7>Fe
3+>I
2,故答案为:K
2C
r2O
7>Fe
3+>I
2.
点评:本题考查学生氧化还原反应中的基本概念和电子转移知识以及氧化性强弱的判断规律,综合性较强,难度较大.

 ,故答案为:
,故答案为: ;
;

 导学教程高中新课标系列答案
导学教程高中新课标系列答案 小学课时特训系列答案
小学课时特训系列答案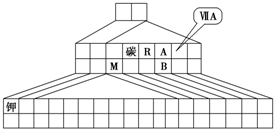 如图是元素周期表的另一种画法--三角形元素周期表的一部分,图上标有第ⅦA族和碳、钾两种元素的位置.
如图是元素周期表的另一种画法--三角形元素周期表的一部分,图上标有第ⅦA族和碳、钾两种元素的位置.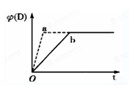 已知反应3A(g)+2B(g)?C(g)+4D(g);△H<0,如图中a、b表示一定条件下,D的体积分数随时间t的变化情况.若要使曲线b变为曲线a,可采取的措施是( )
已知反应3A(g)+2B(g)?C(g)+4D(g);△H<0,如图中a、b表示一定条件下,D的体积分数随时间t的变化情况.若要使曲线b变为曲线a,可采取的措施是( )