

| A. | 用图1所示装置从KI和I2的固体混合物中回收I2 | |
| B. | 用图2所示装置配制100mL0.10mol•L-1 K2Cr2O7溶液 | |
| C. | 用图3所示装置干燥少量的SO2的气体 | |
| D. | 用图4所示装置蒸干FeCl3饱和溶液制备FeCl3晶体 |
分析 A.碘易升华,回收碘需要在上方利用玻璃片回收;
B.配制100mL0.10mol•L-1 K2Cr2O7溶液,一定需要100mL容量瓶;
C.浓硫酸与二氧化硫不反应,可吸收水;
D.FeCl3饱和溶液水解生成的HCl易挥发.
解答 解:A.碘易升华,回收碘需要在上方利用玻璃片回收,则图中装置不能回收碘,故A错误;
B.配制100mL0.10mol•L-1 K2Cr2O7溶液,一定需要100mL容量瓶、胶头滴管,图中缺少仪器不能完成实验,故B错误;
C.浓硫酸与二氧化硫不反应,可吸收水,则图中洗气装置可干燥少量的SO2的气体,故C正确;
D.FeCl3饱和溶液水解生成的HCl易挥发,蒸干不能得到氯化铁,故D错误;
故选C.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、反应原理、实验装置的作用、基本技能为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.


科目:高中化学 来源: 题型:解答题
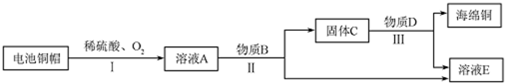
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
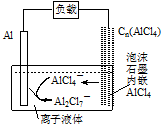 最近中美研究人员发明了一种可快速充放电的铝离子电池,该电池电解质为离子液体{AlCl3/[EMIM]Cl},放电时有关离子转化如图所示.下列说法正确的是( )
最近中美研究人员发明了一种可快速充放电的铝离子电池,该电池电解质为离子液体{AlCl3/[EMIM]Cl},放电时有关离子转化如图所示.下列说法正确的是( )| A. | 充电时,阴极发生:4Al2Cl7-+3e-═Al+7AlCl4- | |
| B. | 充电时,泡沫石墨极与外电源的负极相连 | |
| C. | 放电时,负极发生:2AlCl4--e-═Al2Cl7-+Cl- | |
| D. | 放电时,电路中每流过3mol电子,正极减少27g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
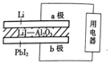 某锂碘电池以LiI-Al2O3固体为电解质传递离子,其基本结构示意图如下,电池总反应可表示为:2Li+PbI2═2LiI+Pb,下列说法正确的是( )
某锂碘电池以LiI-Al2O3固体为电解质传递离子,其基本结构示意图如下,电池总反应可表示为:2Li+PbI2═2LiI+Pb,下列说法正确的是( )| A. | 电子由b极经用电器流向a极 | |
| B. | I-由a极通过固体电解质传递到b极 | |
| C. | b极上的电极反应式为:PbI2+2e-═Pb+2I- | |
| D. | b极质量减少1.27g时,a极转移的电子数约为6.02×1021 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 大力推广燃煤发电以满足工业发展的用电需求 | |
| B. | 加强生活污水的除磷处理,遏制水体的富营养化 | |
| C. | 实施化石燃料脱硫硝技术,减少大气污染物的排放 | |
| D. | 用CO2合成聚碳酸酯可降解塑料,实现“碳”的循环利用 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
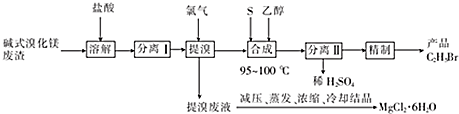
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5.6 g铁与足量稀硝酸反应,转移电子的数目为0.2 NA | |
| B. | 标准状况下,22.4 L二氯甲烷的分子数约为NA | |
| C. | 8.8g乙酸乙酯中含共用电子对数为1.4 NA | |
| D. | 1 L 0.1 mol•L-1氯化铜溶液中铜离子数为0.1 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
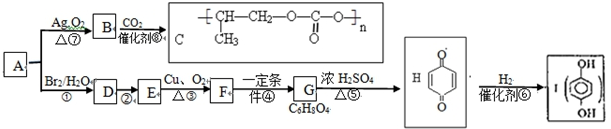
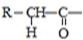 $\stackrel{一定条件下}{→}$
$\stackrel{一定条件下}{→}$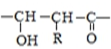
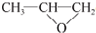 ;⑤的反应类型是消去反应.
;⑤的反应类型是消去反应.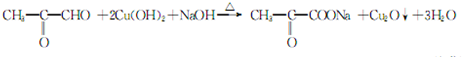 ;
;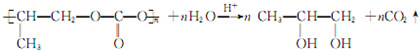 .
.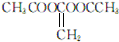 或
或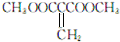 )(任写两种)
)(任写两种)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com