
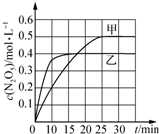
 �������������������������������ӦΪ��2NO2��g��+O3��g��?N2O5��g��ʮO2��g����H����ͬ�¶��£������������з���������Ӧ�������Ϣ�����ͼ��ʾ��
�������������������������������ӦΪ��2NO2��g��+O3��g��?N2O5��g��ʮO2��g����H����ͬ�¶��£������������з���������Ӧ�������Ϣ�����ͼ��ʾ��| ���� | �� | �� | �� |
| �ݻ�/L | 1 | 1 | 2 |
| ��Ӧ�� | |||
| ��ʼ�� | 2mol NO2 | ||
| 1mol O3 | 2mol NO2 | ||
| 1mol O3 | 2mol N2O5 | ||
| 1mol O2 | |||
| �¶�/K | T1 | T2 | T2 |
| A�� | 0��10 min�ڼ������з�Ӧ��ƽ�����ʣ�v��NO2��=0.02 mol•L-1•min-1 | |
| B�� | T1��T2����H��0 | |
| C�� | ƽ��ʱN2O5Ũ�ȣ�c����N2O5����c����N2O5�� | |
| D�� | T1Kʱ������ʼʱ���������г���2 mol NO2��1 mol O3��2 mol N2O5��2 mol O2����������Ӧ�ﵽƽ��ǰ��v��������v���棩 |
���� A�� ͼ�������֪��N2O5��g������Ũ��0.2mol/L��������NO2Ũ��0.4mol/L������v��NO2����0��10min�ڼ������з�Ӧ��ƽ������=$\frac{��c}{��t}$��
B���ȹ���ƽ�¶ȸߣ�T1��T2���¶�Խ��N2O5��g��Ũ��ԽС�����ƽ���ƶ�ԭ��������
C��������м�����ʽ����Ũ�ȣ���ѧ��Ӧ�ﵽƽ��״̬���ܽ��г�������
D������ʼʱ���������г���2molNO2��1molO3��2molN2O5��2mol O2������Ũ����Qc��ƽ�ⳣ���Ƚ��жϷ�Ӧ���еķ���
��� �⣺A����ͼ��֪��0��10min�ڼ�������N2O5��Ũ�ȱ仯��Ϊ0.2mol•L-1��2NO2��g��+O3��g��?N2O5��g��ʮO2��g����������NO2Ũ��0.4mol/L����Ӧ����v��NO2��=$\frac{0.4mol/L}{10min}$=0.04mol/��L•min������A����
B���ȹ���ƽ�¶ȸߣ�T1��T2���¶�Խ��N2O5��g��Ũ��ԽС��˵���¶�����ƽ��������У���Ӧ��H��0����B����
C���������ݻ�ѧ���м���õ���
2NO2��g��+O3?N2O5��g��+O2��g����
2 1 0 0
0.8 0.4 0.4 0.4
1.2 0.6 0.4 0.4
����2NO2��g��+O3?N2O5��g��+O2��g����
1 2 0
ƽ��ʱN2O5Ũ�ȣ�c����N2O5����c����N2O5������C����
D������ʼʱ���������г���2molNO2��1molO3��2molN2O5��2mol O2������Ũ����Qc=$\frac{2��2}{{2}^{2}��1}$=1���൱�ڼ���������������Ӧ������У���������Ӧ�ﵽƽ��ǰ��v��������v���棩����D��ȷ��
��ѡD��
���� ���⿼���˻�ѧƽ�⡢��ѧ��Ӧ����Ӱ�����صķ���Ӧ�ã�ͼ��仯����ֵ�ļ����ǽ���ؼ�����Ŀ�Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ڱ�״���£�22.4L N2��CO������������Ϊ28g | |
| B�� | ���³�ѹ�£��������ᷴӦ����2gH2��ת�Ƶ�����Ϊ2NA | |
| C�� | ��0.2NA�������ӵ�Na2O2��ˮ��Ӧʱ��ת��0.2mol����22.4L | |
| D�� | 1L��NA��NH3•H2O�İ�ˮ����Ũ��Ϊ1mol•L-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��ϩ������7���Ҽ���1���м� | |
| B�� | ��ϩ�����е�̼ԭ����sp3��sp2�����ӻ����� | |
| C�� | ��ϩ���ӵ�����ԭ�ӹ�ƽ�� | |
| D�� | ��ϩ������3��̼ԭ����ͬһֱ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
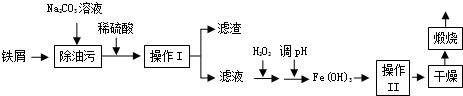
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| t/min | 0.00 | 1.00 | 2.00 | 3.00 | 4.00 | 5.00 |
| c��N2O5��/��mol•L-1�� | 1.00 | 0.71 | 0.50 | 0.35 | 0.25 | 0.17 |

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��һ�������£�ij���淴Ӧ�ġ�H=+100kJ•mol-1����÷�Ӧ����Ӧ��ܱ��淴Ӧ��ܴ�100kJ•mol-1 | |||||||||
| B�� | H2��g��+Br2��g���T2HBr��g����H=-72kJ•mol-1��������������±���
| |||||||||
| C�� | �ڸ��������£�9.6g�����11.2g���ۻ�ϼ�������������17.6 gʱ���ų�19.12 kJ���������Ȼ�ѧ����ʽΪFe��s��+S��s���TFeS��s������H=-95.6 kJ•mol-1 | |||||||||
| D�� | ��2H2��g��+O2��g���T2H2O��g����H=-483.6 kJ•mol-1����H2ȼ����Ϊ-241.8 kJ•mol-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 W��Y��Z��Q��R�����ڱ���ǰ�����ڵ�Ԫ�أ���ԭ��������������̬W��ԭ�Ӻ�����2��δ�ɶԵ��ӣ�Q�ǵ縺������Ԫ�أ���̬R��ԭ�Ӻ���δ�ɶԵ�������Wԭ�Ӻ���δ�ɶԵ�������2�������ʴ��������⣨����ʱ��W��Y��Z��Q��R������Ӧ��Ԫ�ط��ű�ʾ����
W��Y��Z��Q��R�����ڱ���ǰ�����ڵ�Ԫ�أ���ԭ��������������̬W��ԭ�Ӻ�����2��δ�ɶԵ��ӣ�Q�ǵ縺������Ԫ�أ���̬R��ԭ�Ӻ���δ�ɶԵ�������Wԭ�Ӻ���δ�ɶԵ�������2�������ʴ��������⣨����ʱ��W��Y��Z��Q��R������Ӧ��Ԫ�ط��ű�ʾ����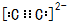 ����̬Rԭ�ӵļ۵����Ų�ʽΪ3d64s2��
����̬Rԭ�ӵļ۵����Ų�ʽΪ3d64s2���鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com