
| A£® | ¼×ĶéµÄ±ź×¼Č¼ÉÕČČĪŖ890.3kJ£®mol-1£¬Ōņ¼×ĶéČ¼ÉÕµÄČČ»Æѧ·½³ĢŹ½æɱķŹ¾ĪŖ£ŗCH4£Øg£©+2O2£Øg£©ØTCO2£Øg£©+2H2O£Øg£©”÷H=-890.3kJ£®mol-1 | |
| B£® | CO£Øg£©µÄČ¼ÉÕČČŹĒ283.0 kJ/mol£¬ŌņCO2£Øg£©ØT2CO£Øg£©+O2£Øg£©µÄ·“Ó¦ČČ”÷H=+2”Į283.0 kJ/mol | |
| C£® | NaOHŗĶHCl·“Ó¦µÄÖŠŗĶČČ”÷H=-57.3kJ/mol£¬ŌņH2SO4ŗĶCa£ØOH£©2·“Ó¦µÄÖŠŗĶČČ”÷H=2”Į£Ø-57.3£©kJ/mol | |
| D£® | 500”ę”¢30MPaĻĀ£¬½«0.5mol N2ŗĶ1.5molH2ÖĆÓŚĆܱյÄČŻĘ÷ÖŠ³ä·Ö·“Ӧɜ³ÉNH3£Øg£©£¬·ÅČČ19.3kJ£¬ĘäČČ»Æѧ·½³ĢŹ½ĪŖ£ŗN2£Øg£©+3H2£Øg£©$?_{550”ę£¬30Mpa}^{“߻ƼĮ}$2NH3£Øg£©”÷H=-38.6kJ/mol |
·ÖĪö A”¢Č¼ÉÕČČŹĒÉś³ÉĪČ¶ØµÄŃõ»ÆĪļ£»
B”¢øł¾ŻČ¼ÉÕČȵÄøÅÄī½įŗĻČČ»Æѧ·½³ĢŹ½µÄĢŲµć·ÖĪö£»
C”¢ÖŠŗĶČČŹĒÖøŌŚĻ”ČÜŅŗÖŠ£¬ĒæĖįŗĶĒæ¼ī·“Ӧɜ³É1molĖ®Ź±·Å³öµÄČČĮ棻
D”¢0.5molN2ŗĶ1.5molH2ÖĆÓŚĆܱÕČŻĘ÷ÖŠ³ä·Ö·“Ӧɜ³ÉNH3£Øg£©£¬·ÅČČ19.3kJ£¬Éś³ÉµÄ°±ĘųµÄĪļÖŹµÄĮæŠ”ÓŚ1mol£®
½ā“š ½ā£ŗA”¢Č¼ÉÕČČŹĒÉś³ÉĪČ¶ØµÄŃõ»ÆĪļ£¬Ė®ĪŖŅŗĢ¬Ė®£¬¶ų²»ŹĒĘųĢ¬Ė®£¬¹ŹA“ķĪó£»
B”¢CO£Øg£©µÄČ¼ÉÕČČŹĒ283.0kJ/mol£¬Ōņ±ķŹ¾Č¼ÉÕČȵÄČČ»Æѧ·½³ĢŹ½ĪŖ£ŗCO£Øg£©+$\frac{1}{2}$O2£Øg£©ØTCO2£Øg£©”÷H=-283.0kJ/mol£¬µ±·½³ĢŹ½·“Š“”÷H·ūŗÅĻą·“£¬¼ĘĮæŹż±ä»Æ¼ø±¶”÷HŅ²ŅŖ±ä»Æ¼ø±¶£¬ĖłŅŌ2CO2£Øg£©ØT2CO£Øg£©+O2£Øg£©·“Ó¦µÄ”÷H=+2”Į283.0kJ/mol£¬¹ŹBÕżČ·£»
C”¢ÖŠŗĶČČŹĒÖøŌŚĻ”ČÜŅŗÖŠ£¬ĒæĖįŗĶĒæ¼ī·“Ӧɜ³É1molĖ®Ź±·Å³öµÄČČĮ棬ĘäŗāĮæ±ź×¼ŹĒÉś³ÉµÄĖ®ĪŖ1mol£¬¹ŹĪŽĀŪĻ”H2SO4ŗĶCa£ØOH£©2·“Ӧɜ³ÉµÄĖ®ŹĒ¼øĦ¶ū£¬ĘäÖŠŗĶČČŗćĪŖ57.3KJ/mol£¬¹ŹC“ķĪó£»
D”¢0.5molN2ŗĶ1.5molH2ÖĆÓŚĆܱÕČŻĘ÷ÖŠ³ä·Ö·“Ӧɜ³ÉNH3£Øg£©£¬·ÅČČ19.3kJ£¬Éś³ÉµÄ°±ĘųµÄĪļÖŹµÄĮæŠ”ÓŚ1mol£¬ĖłŅŌ·“Ó¦N2£Øg£©+3H2£Øg£©$?_{550”ę£¬30Mpa}^{“߻ƼĮ}$2NH3£Øg£©·Å³öµÄČČĮæ“óÓŚ38.6kJ£¬¹ŹD“ķĪó£»
¹ŹŃ”B£®
µćĘĄ ±¾Ģāæ¼²éѧɜČČ»Æѧ·½³ĢŹ½µÄŗ¬Ņå”¢Č¼ÉÕČȵÄøÅÄī”¢ÖŠŗĶČȵÄøÅÄīµČÖŖŹ¶£¬×¢ŅāÖŖŹ¶µÄŹįĄķŗĶ¹éÄÉŹĒ½āĢāµÄ¹Ų¼ü£¬ÄŃ¶Č²»“ó£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
| Ģ¼ | µŖ | Y | |
| X | Įņ | Z |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ŅŅĻ©µÄ½į¹¹¼ņŹ½£ŗCH2CH2 | B£® | ŅŅĶéµÄ½į¹¹Ź½£ŗC2H6 | ||
| C£® | ±½µÄ·Ö×ÓŹ½£ŗ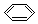 | D£® |  --¼×»łµÄµē×ÓŹ½£® --¼×»łµÄµē×ÓŹ½£® |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | Na2O2 | B£® | KOH | C£® | CaCl2 | D£® | CO2 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | Fe·Ö±šÓėĀČĘųŗĶĻ”ŃĪĖį·“Ó¦ĖłµĆĀČ»ÆĪļĻąĶ¬ | |
| B£® | K”¢Zn·Ö±šÓė²»×ćĮæµÄĻ”ĮņĖį·“Ó¦ĖłµĆČÜŅŗ¾ł³ŹÖŠŠŌ | |
| C£® | Li”¢Na”¢KµÄŌ×Ó°ė¾¶ŗĶĆܶČĖęŌ×ÓŠņŹżµÄŌö¼Ó¶ųŌö“ó | |
| D£® | C”¢S”¢ClµÄ×īøß¼ŪŃõ»ÆĪļ¶ŌÓ¦Ė®»ÆĪļµÄĖįŠŌÖš½„ŌöĒæ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| Na2O | Na | AlF3 | AlCl3 | Al2O3 | BCl3 | CO2 | SiO2 |
| 920”ę | 97.8”ę | 1 291”ę | 190”ę | 2 073”ę | -107”ę | -57”ę | 1 723”ę |
| A£® | Ö»ŅŖÓɽšŹōŌŖĖŲŗĶ·Ē½šŹōŌŖĖŲŠĪ³ÉµÄ¾§Ģå¾ĶŅ»¶ØŹĒĄė×Ó¾§Ģå | |
| B£® | ŌŚ¹²¼Ū»ÆŗĻĪļ·Ö×ÓÖŠø÷Ō×Ó¶¼ŠĪ³É8øöµē×ÓµÄĪČ¶Ø½į¹¹ | |
| C£® | ½šŹō¾§ĢåµÄČŪµć²»Ņ»¶Ø±Č·Ö×Ó¾§ĢåµÄøß | |
| D£® | Ķ¬×åŌŖĖŲµÄŃõ»ÆĪļ²»æÉÄÜŠĪ³É²»Ķ¬ĄąŠĶµÄ¾§Ģå |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | MgO+H2SO4ØTMgSO4+H2O | B£® | Na2O+H2OØT2NaOH | ||
| C£® | Zn+H2SO4ØTZnSO4+H2”ü | D£® | SO3+H2OØTH2SO4 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2016-2017ѧğŗÓ±±Ź”øßŅ»ÉĻ10ŌĀŌĀæ¼»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗĢīæÕĢā
£Ø1£©Ä³ĘųĢåŌŚ±ź×¼×“æöĻĀµÄĆܶČĪŖ1£®25g”¤L-1£¬Ōņ 28gøĆĘųĢåĖłŗ¬ÓŠµÄ·Ö×ÓŹżĪŖ ”£
£Ø2£©14£®2g(NH4)2C2O4”¤xH2OÖŠŗ¬ÓŠ1£®204”Į1023øöNH4+£¬øĆĪļÖŹµÄĦ¶ūÖŹĮæŹĒ £¬xµÄÖµŹĒ ”£
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com