
 按要求完成下列两题:
按要求完成下列两题:| m |
| M |
| 5.4g |
| 18g/mol |
| 30g |
| 100g/mol |
| 7.4g |
| 74g/mol |
| 0.3mol |
| 0.1mol |
| 0.6mol |
| 0.1mol |
| 74-12×3-6 |
| 2 |


科目:高中化学 来源: 题型:
| A、随着元素原子序数的递增,元素最高正价从+1到+7、负价从-7到-1重复出现 |
| B、元素性质的周期性变化是指原子核外电子排布、原子半径及元素主要化合价的周期性变化 |
| C、随着元素原子序数的递增,原子半径从小到大(稀有气体除外)发生周期性变化 |
| D、在元素周期表中有些元素既表现出一定的金属性又表现出一定的非金属性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 名称 | 托盘天平(带砝码) | 小烧杯 | 坩埚钳 | 玻璃棒 | 药匙 | 量筒 |
| 仪器 | 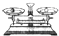 |
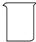 |
 |
 |
 |
 |
| 序号 | a | b | c | d | e | f |
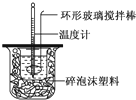
| 温度 实验次数 |
超始温度t1/℃ | 终止温度t2/℃ | 平均温度差 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某化学兴趣小组要完成中和热的测定.
某化学兴趣小组要完成中和热的测定.| 实 验 用 品 | 溶 液 温 度 | 中和热△H(平均值) | ||
| t1 | t2 | |||
| ① | 50mL0.55mol?L-1NaOH 50mL.0.5mol?L-1HCl |
20℃ | 23.3℃ | |
| ② | 50mL0.55mol?L-1NaOH 50mL.0.5mol?L-1HCl |
20℃ | 23.5℃ | |
查看答案和解析>>
科目:高中化学 来源: 题型:
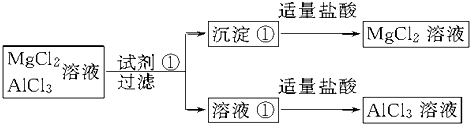
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
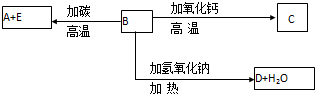
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向饱和FeCl3溶液中滴加过量稀氨水,可制取Fe(OH)3胶体 |
| B、向淀粉溶液中加入稀硫酸,加热,冷却后加入新制Cu(OH)2,再加热,无砖红色沉淀出现,则证明淀粉没有发生水解 |
| C、常温下,向盛有2mL 0.1mol?L-1 AgNO3溶液的试管中滴加2滴同浓度的NaCl溶液,生成白色沉淀,再向其中滴加0.1mol?L-1的KI溶液又生成黄色沉淀,说明Ksp(AgI)<Ksp(AgCl) |
| D、取少量溶液X,向其中加入几滴KSCN溶液无明显变化,再加适量新制氯水溶液变红,说明X溶液中一定含有Fe2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com