
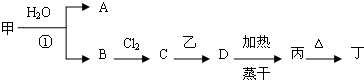
分析 某金属氢化物甲的焰色反应为黄色,则甲为NaH,NaH与水反应生成NaOH与H2,乙为常见的金属单质,既可与A反应又可与C反应,均能生成气体单质B,结合转化关系可知,A为NaOH,B为H2,C为HCl,乙为Al,D为AlCl3,丙为Al(OH)3,丁为Al2O3.
解答 解:某金属氢化物甲的焰色反应为黄色,则甲为NaH,NaH与水反应生成NaOH与H2,乙为常见的金属单质,既可与A反应又可与C反应,均能生成气体单质B,结合转化关系可知,A为NaOH,B为H2,C为HCl,乙为Al,D为AlCl3,丙为Al(OH)3,丁为Al2O3.
(1)甲为NaH,电子式Na+[:H]-;反应①的化学方程式为NaH+H2O=NaOH+H2↑,
故答案为:Na+[:H]-;NaH+H2O=NaOH+H2↑;
(2)C为HCl,存在化学键的类型为共价键,故答案为:共价键;
(3)工业上由丁制乙的化学反应方程式:2Al2O3(熔融)$\frac{\underline{\;电解\;}}{\;}$4Al+3O2↑,
故答案为:2Al2O3(熔融)$\frac{\underline{\;电解\;}}{\;}$4Al+3O2↑;
(4)由D溶液加热蒸干得到丙的化学方程式:AlCl3+3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Al(OH)3↓+3HCl↑,
故答案为:AlCl3+3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Al(OH)3↓+3HCl↑.
点评 本题考查无机物推断,涉及Al、Na等元素化合物性质,金属氢化物在中学基本不涉及,在题目中经常涉及,要引起重视,利用水解原理理解氢化钠与水的反应.


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 改用100mL2mol•L-1盐酸 | B. | 加入碳酸钠固体 | ||
| C. | 滴加少量CuCl2溶液 | D. | 降低温度 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 植物油与聚乙烯均能使溴水褪色 | |
| B. | 淀粉与纤维素均为高分子化合物且互为同分异构体 | |
| C. | 蔗糖与麦芽糖的水解产物均为葡萄糖 | |
| D. | 丙烷与2-甲基丙烷的一氯代物均为两种 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | N2O结构式可表示为N=N=O | |
| B. | O3分子呈直线形 | |
| C. | CH2=CH-CHO分子中碳原子均采用sp2杂化 | |
| D. | 相同压强下,HCOOH沸点比CH3OCH3高,说明前者是极性分子,后者是非极性分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通过“扫描隧道显微镜”操纵原子“书写”文字 | |
| B. | 14C考古断代 | |
| C. | 煤焦油分馏得到苯及其同系物 | |
| D. | 粮食酿酒 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用米汤检验碘盐中的碘 | |
| B. | 用热的烧碱溶液洗涤餐具上的油污 | |
| C. | “地沟油”禁止食用,但可用来制取肥皂 | |
| D. | 将洁厕灵与84消毒液混合使用,能更有效的起到洁具除垢和卫生消毒作用 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com