
某课外活动小组设计了如图所示的实验装置进行实验,回答下列问题:
(1)开始实验时夹子e是打开的,锥形瓶A中发生反应的离子方程式为:______________,试剂瓶B中可以观察到的现象是_____________________。
(2)数分钟后夹上夹子e,则试剂瓶B中可以观察到的现象是____,B中反应的离子方程式是_____________。
(3)如果开启活塞f放掉约2/3液体,此时试剂瓶B中可能出现的现象是____________________,B中反应的化学方程式是_____________________。
(1)Fe + 2H+ = Fe2+ + H2↑ 导管口有气泡冒出
(2)A中溶液进入B,立即产生白色沉淀 H+ + OH-= H2O, Fe2+ + 2OH-= Fe(OH)2↓
(3)沉淀逐渐变成灰绿色,最终变成红褐色, 4Fe(OH)2 + O2 + 2H2O= 4Fe(OH)3
解析试题分析:Fe与稀硫酸发生反应的化学方程式为Fe+H2SO4=FeSO4+H2↑其离子方程式为:Fe + 2H+ = Fe2+ + H2↑。A中产生的气体通过导气管到B的溶液中,会看到在导气管口产生气泡。(2)数分钟后夹上夹子e,A中还在继续反应产生气体,使容器A的气压增大,这时A中反应产生的FeSO4就会被压入到B容器中,与NaOH溶液反应产生白色Fe(OH)2沉淀。B中反应的离子方程式是H+ + OH-= H2O,Fe2+ + 2OH-= Fe(OH)2↓(3)如果开启活塞f放掉约2/3液体,因为空气的进入,白色不稳定的Fe(OH)2会被氧化为红褐色的Fe(OH)3.因此此时试剂瓶B中可能出现的现象是沉淀逐渐变成灰绿色,最终变成红褐色。反应的化学方程式是4Fe(OH)2 + O2 + 2H2O= 4Fe(OH)3。
考点:考查Fe(OH)2的制取与性质的知识。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:实验题
铝镁合金是飞机制造、化工生产等行业的重要材料。研究性学习小组的同学,为测定某含镁3%~5%的铝镁合金(不含其他元素)中镁的质量分数,设计了下列两种不同实验方案进行探究。填写下列空白:
【方案一】
【实验方案】将铝镁合金与足量NaOH溶液反应,测定剩余固体质量。
实验中发生反应的化学方程式是_____________________________。
【实验步骤】
(1)称取10.8 g铝镁合金粉末样品,溶于体??为V物质的量浓度为4.0 mol·L-1 NaOH溶液中,充分反应。则NaOH溶液的体积V≥_________mL。
(2)过滤、洗涤、干燥、称量固体。该步骤中若未洗涤固体,测得镁的质量分数将________(填“偏高”、“偏低”或“无影响”)。
【方案二】
【实验方案】将铝镁合金与足量稀硫酸溶液反应,测定生成气体的体积。
【实验步骤】
(1)同学们拟选用下列实验装置完成实验: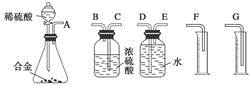
你认为最简易的装置其连接顺序是A接( )( )接( )( )接( )(填接口字母,可不填满)。
(2)仔细分析实验装置后,同学们经讨论认为以下两点会引起较大误差:稀硫酸滴入锥形瓶中,即使不生成氢气,也会将瓶内空气排出,使所测氢气体积偏大;实验结束时,连接广口瓶和量筒的导管中有少量水存在,使所测氢气体积偏小。于是他们设计了如图所示的实验装置。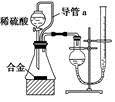
①装置中导管a的作用是_______________。
②实验前后量气管中液面读数分别为V1 mL、V2mL,则产生氢气的体积为___mL。
③若需确定产生氢气的量,还需测定的数据是______。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某小组取一定质量的FeSO4固体,利用下图装置进行实验。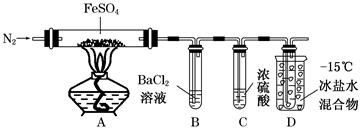
| 实验 | 实验过程 | 实现现象 |
| ① | 通入一段时间N2,加热 | A中固体变为红棕色,B中有白色沉淀,D试管中有无色液体 |
| ② | 用带有火星的木条靠近装置D的导管口 | 木条复燃 |
| ③ | 充分反应,停止加热,冷却后,取A中固体,加盐酸 | 固体溶解,溶液呈黄色 |
| ④ | 将③所得溶液滴入D试管中 | 溶液变为浅绿色 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
铝镁合金已成为轮船制造、化工生产等行业的重要材料。研究性学习小组的三位同学,为测定某含镁3%~5%的铝镁合金(不含其他元素)中镁的质量分数,设计了下列三种不同实验方案进行探究。填写下列空白。
【探究一】实验方案:铝镁合金 测定剩余固体质量,实验中发生反应的化学方程式是_________________________。
测定剩余固体质量,实验中发生反应的化学方程式是_________________________。
实验步骤:
(1)称取5.4 g铝镁合金粉末样品,投入V mL 2.0 mol·L-1 NaOH溶液中,充分反应。NaOH溶液的体积V≥______。
(2)过滤、洗涤、干燥、称量固体。该步骤中若未洗涤固体,测得镁的质量分数将______(填“偏高”或“偏低”)。
【探究二】实验方案:铝镁合金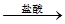 测定生成气体的体积实验装置:
测定生成气体的体积实验装置:
问题讨论:
(1)某同学提出该实验装置不够完善,应在A、B之间添加一个干燥、除酸雾的装置。你的意见是:_____(填“需要”或“不需要”)。
(2)为使测定结果尽可能精确,实验中应注意的问题是(写出两点):
①______________________________。
②______________________________。
【探究三】
实验方案:称量x g铝镁合金粉末,放在如图所示装置的惰性电热板上,通电使其充分灼烧。
问题讨论:
(1)欲计算镁的质量分数,该实验中还需测定的数据是______。
(2)若用空气(不考虑CO2)代替O2进行实验,对测定结果有何影响? _____(填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
一位学生对铁与氧化铁反应后的产物进行探究。
(1)提出假设
假设1:产物为FeO;
假设2:__________________。
(2)查阅资料
该学生通过查阅资料得知:在铁的三种氧化物中,四氧化三铁最稳定,氧化亚铁最不稳定,常温下极易被氧气氧化成氧化铁(颜色由黑色变成红色)。
通过查阅资料可以得出的初步结论为_________________________________。
(3)进行实验
该学生设计了如下装置进行铁与氧化铁反应的实验。请你帮助他将实验步骤补充完整。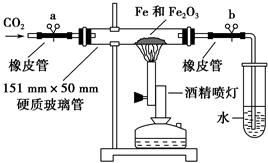
按如图装置连接好仪器(暂不装入药品),___________________ ____。
②称取1 g还原性铁粉和5 g氧化铁粉末,混合均匀后平摊在玻璃管中部。
③松开两个弹簧夹,_______________________________________________,
即可夹上弹簧夹a,并开始加热药品。
④大约4分钟左右,棕色粉末全部变黑;再夹上弹簧夹b,然后停止加热,等到玻璃管冷却至室温,倒出黑色粉末。
(4)现提供如下药品,验证实验得到的黑色粉末的成分。磁铁、稀盐酸、KSCN溶液、酸性KMnO4溶液、试管、胶头滴管。
| 实验步骤 | 预期现象和结论 |
| | |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某校化学兴趣小组为探究铁与浓硫酸反应,设计了图1、图2所示装置进行实验。
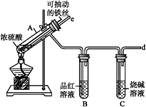
图1 图2
(1)比较两实验装置,图2装置的优点是:
①能更好地吸收有毒气体SO2,防止其污染环境;
② 。
(2)导气管e有两个主要作用:一是在反应过程中,因导管插入液面下,可起到“液封”作用阻止SO2气体逸出而污染环境;二是 。
(3)能说明有SO2气体产生的实验现象是 。
(4)反应一段时间后,用滴管吸取A试管中的溶液滴入适量水中为试样,试样中所含金属离子的成分有以下三种可能:
Ⅰ:只含有Fe3+;Ⅱ:只含有Fe2+;Ⅲ:既有Fe3+又有Fe2+。
为验证Ⅱ、Ⅲ的可能性,选用如下试剂,填写下列空格:
| A.稀HCl溶液 | B.稀H2SO4溶液 | C.KSCN溶液 | D.KMnO4溶液 |
 Fe(SCN)3。
Fe(SCN)3。 查看答案和解析>>
科目:高中化学 来源: 题型:实验题
欲测定含少量氯化钠的小苏打固态样品中NaHCO3的质量分数可采用以下四种方法。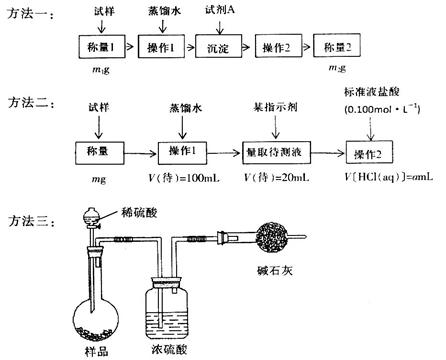
方法四:不使用化学试剂,使用实验室常用仪器。
按要求回答下列问题:
(1)方法一是将HCO3-离子转化为沉淀并称重,则试剂A为______________(填化学式)溶液;操作2包括_______________________。
(2)方法二操作1中要用到的玻璃仪器有烧杯、玻璃棒,还需要___________________;操作2的名称是__________;该样品中NaHCO3的质量分数为_________(用含m、a的表达式表示)。
(3)根据方法三中所用的实验装置,除了称量试样质量外,还需测定的实验数据是_______________;仔细分析该实验装置,由此测得的数据计算出的实验结果有可能偏高也有可能偏低,偏高的原因可能是______________________________;偏低的原因可能是____________________________。
(4)方法四的实验原理是________________(用化学方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
为测定Na2CO3和NaHCO3固体混合物中Na2CO3的质量分数,称取一定质量的样品,甲同学利用图I所示装置测量产生CO2的体积,乙同学利用图II所示装置通过干燥管的增重测量产生CO2的质量,已知所用稀硫酸均足量。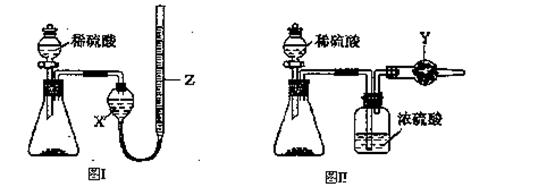
(l)盛放稀硫酸的仪器名称为 ;
(2)试剂X为 ,试剂Y为 ;
(3)甲同学在进行实验时,为减小误差,应注意的事项有(填选项字母) ;
| A.读数前应使整套装置冷却至室温 |
| B.调整Z的高度使量气装置左右液面相平 |
| C.读数时视线与Z内凹液面最低点相切 |
| D.读数前应通入一定量的N2使生成的CO2全部进入量气装置 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(10分)某氯化铁样品含有FeCl2杂质。现要测定其中铁元素的质量分数,实验按以下步骤进行: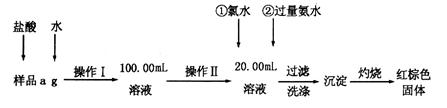
(1)操作I所用到的玻璃仪器除烧杯、玻璃棒外,还必须有________________________(填仪器名称)。
(2)写出加入氯水发生反应的离子方程式____________________。
(3)检验沉淀已经洗涤干净的操作及现象是______________________________________
___________________________________________________________________________。
(4)坩埚质量为W1g,加热后坩埚与红棕色固体总质量为W2g,则样品中铁元素的质量分数是____________________(列出原始算式,不需化简);若称量准确而最终测量的结果偏大,则造成误差的原因可能是_____________________(写出一种原因即可)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com