
【题目】Ⅰ实验室里需要纯净的氯化钠溶液,但实验室只有混有硫酸钠、碳酸氢铵的氯化钠.某学生设计了如下方案进行提纯:

(1)操作②能否改为加硝酸钡溶液,______(填“能”或“否”) ,理由_____________________________。
(2)进行操作②后,如何判断SO42- 已除尽,方法是___________________。
(3)操作④的目的是_______________________________。
Ⅱ硫酸亚铁铵(NH4)2SO4·FeSO4·6H2O为浅绿色晶体,实验室中常以废铁屑为原料来制备,其步骤如下:
步骤1 将废铁屑放入碳酸钠溶液中煮沸除油污,分离出液体,用水洗净铁屑。
步骤2 向处理过的铁屑中加入过量的3mol/L H2SO4溶液,在60℃左右使其反应到不再产生气体,趁热过滤,得FeSO4溶液。
步骤3 向所得FeSO4溶液中加入饱和(NH4)2SO4溶液,经过“一系列操作”后得到硫酸亚铁铵晶体。
请回答下列问题:
(1)在步骤1中,分离操作,所用到的玻璃仪器有___________________________。(填仪器编号)
①漏斗 ②分液漏斗 ③烧杯 ④广口瓶 ⑤铁架台 ⑥玻璃棒 ⑦酒精灯
(2)在步骤3中,“一系列操作”依次为_____________________、_______________________和过滤。
(3)实验室欲用18mol/L H2SO4来配制240mL 3mol/L H2SO4溶液,需要量取________mL浓硫酸,实验时,下列操作会造成所配溶液浓度偏低的是__________________。(填字母)
a.容量瓶内壁附有水珠而未干燥处理 b.未冷却至室温直接转移至容量瓶中
c.加水时超过刻度线后又倒出 d.定容时仰视刻度线
【答案】否 改用Ba(NO3)2会使溶液中引入新的杂质离子NO3- 静置,向上层清液中继续滴加BaCl2溶液,溶液不变浑浊,则已除尽 除去滤液中溶解的CO2和多余的盐酸 ①③⑥ 蒸发浓缩 降温结晶 41.7 c d
【解析】
Ⅰ(1) 操作②改为加硝酸钡溶液,会引入新的杂质离子NO3-,得不到纯的氯化钠;
(2) 用氯化钡溶液来判断SO42- 是否已除尽;
(3)操作④进行加热煮沸,可以除去滤液中溶解的CO2和多余的盐酸;
Ⅱ(1)根据过滤操作中所用到的玻璃仪器选用所需的仪器;
(2)由溶液制晶体时,要经过加热浓缩、冷却结晶、过滤、洗涤等步骤;
(3)根据溶液稀释前后溶质的量不变,计算出所需浓硫酸的体积;根据c=n/V进行分析,凡是引起n偏小或V偏大,所测定的结果都会使所配溶液浓度偏低。
Ⅰ(1)本实验的目的最终得到纯净的氯化钠溶液,因此操作②中改为加硝酸钡溶液,会引入新的杂质离子NO3-,得不到纯的氯化钠,因此不能用Ba(NO3)2溶液代替BaCl2溶液;综上所述,本题答案是:否,改用Ba(NO3)2会使溶液中引入新的杂质离子NO3-。
(2) 操作②,加入氯化钡溶液,目的是除去硫酸根离子,因此判断SO42- 已除尽方法是:静置,向上层清液中继续滴加BaCl2溶液,溶液不变浑浊,则已除尽;综上所述,本题答案是:静置,向上层清液中继续滴加BaCl2溶液,溶液不变浑浊,则已除尽。
(3)滤液中剩余的碳酸钠与过量的盐酸反应生成二氧化碳、氯化钠,因此操作④进行的加热煮沸,其目的是除去滤液中溶解的CO2和多余的盐酸;综上所述,本题答案是:除去滤液中溶解的CO2和多余的盐酸。
Ⅱ(1)进行过滤操作,所用到的玻璃仪器有①漏斗,③烧杯,⑥玻璃棒;综上所述,本题答案是:①③⑥。
(2)由溶液制晶体时,要经过加热浓缩、冷却结晶、过滤、洗涤等步骤;本题中一系列操作”依次为加热浓缩、降温结晶和过滤;综上所述,本题答案是:蒸发浓缩 ;降温结晶。
(3)根据溶液稀释前后溶质的量不变规律,实验室没有240mL容量瓶,只能选用250mL容量瓶,因此18×V(浓H2SO4)=250×3, V(H2SO4)=41.7mL;实验时,下列操作会造成偏低的是:
a.容量瓶内壁附有水珠而未干燥处理,不影响溶质的量和溶液的体积,对无影响,不选;
b.未冷却至室温直接转移至容量瓶中,等溶液冷却到室温后,溶液的体积会偏小,所配溶液浓度偏大,不选;
c.加水时超过刻度线后又倒出,造成溶质的量减少,所配溶液浓度偏低,可选;
d.定容时仰视刻度线,造成溶液的体积偏高,所配溶液浓度偏低,可选;
综上所述,本题正确答案是:41.7 ,cd。


科目:高中化学 来源: 题型:
【题目】早在2000多年前,人们发现柳树皮中含有一种具有解热镇痛功效的物质—水杨酸,此后科学家对水杨酸的结构进行一系列改造,合成出疗效更佳的长效缓释阿司匹林,其开发过程蕴含着重要的思想方法,请回答下列问题:

(1)水杨酸的结构与性质
①水杨酸中含氧官能团的名称是____________、______________。
②下列关于水杨酸的说法正确的是__________。
A.分子式为C7H7O3
B.1 mol水杨酸能与2 molNaOH反应
C.可发生加成、取代、消去反应
(2)水杨酸的合成
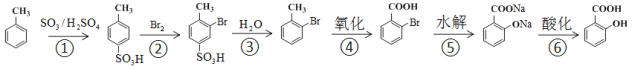
①由![]() 制
制![]() ,不采取甲苯直接与Br2直接反应,而是经过步骤①~③,目的是_______________
,不采取甲苯直接与Br2直接反应,而是经过步骤①~③,目的是_______________
②步骤④~⑥的顺序能够改为水解、酸化、氧化?____________(填“能”或“不能”),理由是__________________________________
(3)水杨酸具有解热镇痛的功效,但是其酸性很强,对人的肠胃有刺激性,容易引发胃溃疡,1897年德国化学家菲利克斯·霍夫曼对水杨酸的结构进行改造合成出阿司匹林。
①水杨酸的酸性主要来源于-COOH,将-OH转化为-OOCCH3,可使-COOH的酸性大大降低。科学家的这一设计思路依据的原理是_________________________________________
②水杨酸到阿司匹林的反应类型是_________
(4)1982年拜尔公司将阿司匹林与聚甲基丙烯酸借助乙二醇嫁接起来,研制出长效缓释阿司匹林,可减少每天吃药次数,大大方便了人们对药物的使用。
①长效缓释阿司匹林在人体内释放出阿司匹林的反应类型是______________
②写出乙烯经2步合成乙二醇的化学方程式_______________________、________________
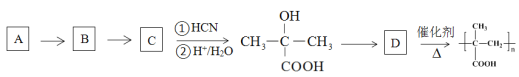
③以烃A为原料,合成聚甲基丙烯酸的路线如下:
已知:
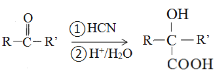
(R、R’为烃基或氢原子)
请填写有机物A~D的结构简式,在所有箭头上标注试剂和条件_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示表示页岩气中某些烃类的结构模型:

(1)有机物甲的名称为____________,有机物甲与有机物乙互为____________。
(2)有机物乙的一氯取代物有________种,请你根据甲烷分子结构示意图推测,有机物乙中最多有________个C原子在同一平面内。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在以下各种情形下,下列电离方程式的书写正确的是
A.熔融状态下的NaHSO4电离:NaHSO4=Na++H++SO42-
B.H2CO3的电离:H2CO3![]() 2H++CO32-
2H++CO32-
C.Fe(OH)3的电离:Fe(OH)3![]() Fe3++3OH-
Fe3++3OH-
D.水溶液中的NaHSO4电离:NaHSO4=Na++HSO4-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无色的混合气体甲,可能含NO、CO2、NO2、N2中的几种,将一定量的甲气体经过如图实验的处理,结果得到酸性溶液,而几乎无气体剩余,则甲气体的组成为( )

A.NO2、N2B.NO、CO2
C.NO2、CO2D.NO、CO2、N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示:在B水槽中装有500 mL水,容积为a mL的试管A充满了NO2和NO的混合气体(标准状况),将试管A倒插入B水槽的水中。充分反应后,试管A中余下气体的体积为0.5a mL。
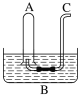
(1)将A倒插入B槽中发生反应的化学方程式为_______________________________________,该反应中氧化剂与还原剂的质量比为________,原混合气体中NO2和NO的物质的量之比为________。
(2)通过导气管C向余下0.5a mL气体的试管A中持续通入氧气,A中可能观察到的现象是_______________________________________________________________________。
(3)当试管A中充满气体时停止通入氧气,然后将试管取出水槽,水槽B中溶液的物质的量浓度为________ mol·L1(设溶液的体积仍为500 mL)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲溶液可能含有K+、Ca2+、NH4+、Cu2+、NO3-、Cl-、SO42-、CO32-八种离子中的若干种![]() 为确定甲溶液的组成,将其分成两等份,进行如下实验:
为确定甲溶液的组成,将其分成两等份,进行如下实验:
①向一份溶液中加入足量的NaOH浓溶液并加热,产生的气体在标准状况下体积为4.48L。
②向另一份溶液中加入0.6 mol/L的BaCl2溶液500mL,恰好可以与溶液中的离子完全反应,过滤得66.3g沉淀及滤液。
③向上述沉淀中加入过量的盐酸,产生的气体通入足量澄清的石灰水中,得到一定量的沉淀X。
④向上述滤液中加入1 mol/L AgNO3溶液650 mL,恰好可完全反应,据此,请回答下列问题![]() 用相应的离子符号表示
用相应的离子符号表示![]() :
:
⑴上述实验③中得到沉淀X的质量为______;生成沉淀X的离子方程式为______.
⑵甲溶液中一定不存在的离子是______;可能存在的离子是______.
⑶甲溶液一定存在的离子中,物质的量最大的离子是______;物质的量最小的离子是______,此物质的量最小的离子其物质的量为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.在![]() 、
、![]() N、
N、![]() O、
O、![]() Cl、
Cl、![]() U、
U、![]() U中:
U中:
(1)___和_____的质量数相等,但不能互称为同位素。
(2)___和____的中子数相等,但质子数不相等,所以不是同一种元素。以上所列共有______种元素。
Ⅱ.物质的类别和核心元素的化合价是研究物质性质的两个基本视角。

(3)Y的分子式为________。
(4)图中X的电子式为![]() ;其水溶液长期在空气中放置容易变浑浊,原因是________(用化学方程式表示);该变化体现出:S非金属性比O____(填“强”或“弱”)。用原子结构解释原因:同主族元素从上到下,__________,得电子能力逐渐减弱。
;其水溶液长期在空气中放置容易变浑浊,原因是________(用化学方程式表示);该变化体现出:S非金属性比O____(填“强”或“弱”)。用原子结构解释原因:同主族元素从上到下,__________,得电子能力逐渐减弱。
(5)Z与图表中某物质反应生成SO2的化学方程式是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】白磷在氧气中燃烧的反应为:P4 + 5O2 = P4O10。已知下列化学键的键能分别为:P—P a kJ·mol-1、P—O b kJ·mol-1、P=O c kJ·mol-1、O=O d kJ·mol-1。根据图示的分子结构和有关数据,下列推断正确的是

A.6a+5d < 4c + 10b
B.△H = (4c+12b-6a-5d) kJ·mol-1
C.6a+5d > 4c + 12b
D.△H = (6a+5d-4c-12b) kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com