
| A. | 该合金中铁的质量为5.4 g | |
| B. | 合金与稀硫酸反应共生成0.45 mol H2 | |
| C. | 该合金与足量氢氧化钠溶液反应,转移的电子数为0.3NA | |
| D. | 所加的稀硫酸中含0.6 mol H2SO4 |
分析 200mL 6mol•L-1 NaOH溶液中含有NaOH的总物质的量为:6mol/L×0.2mol=1.2mol,生成沉淀最多时溶质为硫酸钠,则所加硫酸的物质的量为:$\frac{1.2mol}{2}$=0.6mol;
最终得到的沉淀为氢氧化铝和氢氧化铁的混合物,则生成沉淀时消耗氢氧根离子的物质的量为:$\frac{26.3g-11.0g}{17g/mol}$=0.9mol,则铁和铝的总物质的量为:$\frac{0.9mol}{3}$=0.3mol,设合金中铁的物质的量为x、铝的物质的量为y,则56x+27y=11.0、x+y=0.3,解得:x=0.1mol、y=0.2mol,据此对各选项进行判断.
解答 解:最终得到的沉淀为氢氧化铝和氢氧化铁的混合物,则生成沉淀时消耗氢氧根离子的物质的量为:$\frac{26.3g-11.0g}{17g/mol}$=0.9mol,则铁和铝的总物质的量为:$\frac{0.9mol}{3}$=0.3mol,设合金中铁的物质的量为x、铝的物质的量为y,则56x+27y=11.0、x+y=0.3,解得:x=0.1mol、y=0.2mol;
200mL 6mol•L-1 NaOH溶液中含有NaOH的总物质的量为:6mol/L×0.2mol=1.2mol,生成沉淀最多时溶质为硫酸钠,则所加硫酸的物质的量为:$\frac{1.2mol}{2}$=0.6mol;
A.根据计算可知,合金中含有0.1mol铁,其质量为:56g/mol×0.1mol=5.6g,故A错误;
B.0.1mol铁与稀硫酸反应生成0.1mol氢气,0.2mol铝与稀硫酸反应生成0.3mol氢气,总共生成0.4mol氢气,故B错误;
C.铁不与氢氧化钠溶液反应,0.2mol铝与氢氧化钠溶液反应转移电子为:0.2mol×3=0.6mol,转移的电子数为0.6NA,故C错误;
D.根据分析可知,所加硫酸的物质的量为0.6mol,故D正确;
故选D.
点评 本题考查了混合物反应的计算,题目难度中等,明确恰好沉淀时溶质组成为解答关键,注意掌握质量守恒定律、电子守恒在化学计算中的应用,试题侧重考查学生的分析、理解能力及化学计算能力;B为易错点,注意铁与稀硫酸反应生成的是硫酸亚铁.


 通城学典默写能手系列答案
通城学典默写能手系列答案科目:高中化学 来源: 题型:选择题
| A. | 石油是各种液态烃的混合物 | |
| B. | 常压分馏的原料是重油 | |
| C. | 由分馏塔分馏出的各馏分均是混合物 | |
| D. | 减压分馏的主要产品有汽油、润滑油、煤油和沥青 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 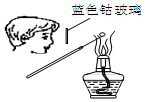 检验Na2CO3 中的Na+ | B. | 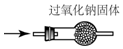 除去CO中混有的CO2 | ||
| C. | 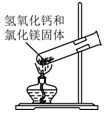 制取氨气 | D. | 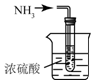 吸收氨气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用稀硫酸溶解四氧化三铁:Fe3O4+8H+═Fe2++2Fe3++4H2O | |
| B. | Ca(HCO2)2溶液中滴加Ba(OH)2溶液至呈中性:Ca2++2HCO3-+Ca2++2OH-═2H2O+BaCO3↓+CaCO3↓ | |
| C. | 向NaHSO4溶液中滴加Ba(OH)2溶液至呈中性:H++SO42-+Ba2++OH-═H2O+BaSO4↓ | |
| D. | 向次氯酸钠溶液中通入SO2:2ClO-+SO2+H2O═SO32-+2HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 1:91 |
| pH | 8.2 | 7.2 | 6.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 28 g氮气含有的原子数为NA | |
| B. | 标准状况下,22.4 L水中含有的水分子数为NA | |
| C. | 1 molOH-含有的电子数为10NA | |
| D. | 0.1 L 1 mol•L-1NaCl溶液中含有Na+个数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯的结构简式为:CH2=CH2 | |
| B. | 原子核内有10个中子的氧原子:${\;}_{8}^{18}$O | |
| C. | 醋酸的分子式:CH3COOH | |
| D. | 乙醇的结构式为: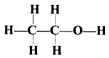 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com