
| A、一定温度下,某溶液的pH<7,则该溶液呈酸性 |
| B、在水中加入少量碳酸钠固体将抑制水的电离 |
| C、0.02mol?L-1CH3COOH溶液和0.01mol?L-1NaOH溶液等体积混合,则溶液中:2c(H+)+c(CH3COOH)=2 c(OH-)+c(CH3COO-) |
| D、浓度均为0.1mol/L的NH4Cl溶液和NH4HSO4溶液,前者的c(NH4+)大于后者 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CH4O与C2H6O一定互为同系物 |
| B、1mol C6H6(苯)中含有3mol碳碳双键 |
| C、用浓硝酸与蛋白质的颜色反应鉴别部分蛋白质 |
| D、向乙酸乙酯中加入NaOH 溶液,振荡,分液分离除去乙酸乙酯中的少量乙酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
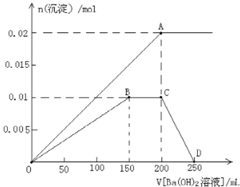 FeCl3在铜版印刷中用作印刷电路铜板腐蚀剂,按要求回答下列问题:
FeCl3在铜版印刷中用作印刷电路铜板腐蚀剂,按要求回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
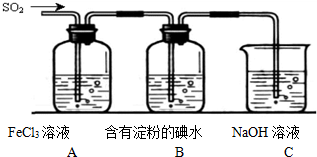
查看答案和解析>>
科目:高中化学 来源: 题型:
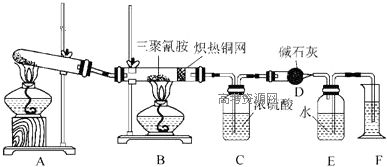
| 装置 | C | D |
| 实验前 | 101.0g | 56.0g |
| 实验后 | 106.4g | 69.2g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在NaHCO3溶液中有:C(CO32-)+C(OH-)=C(H+)+C(H2CO3) |
| B、FeCl3溶液中存在:Fe3++3H2O?Fe(OH)3+3H+ 的水解平衡,给该溶液里加少量HCl或NaOH溶液,都能使该平衡向左移动 |
| C、乙酸乙酯的制取实验中,试剂加入的顺序是:无水乙醇→浓硫酸→冰醋酸 |
| D、实验室制取甲烷的原理是:无水醋酸钠和碱石灰共热,其中碱石灰的成分是NaOH和CaO |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 25℃平衡体系(苯、水HA) | 平衡常数 | 焓变 | 起始总浓度 |
| 在水中,HA?H++A- | K1 | △H1 | 3.0×10-3mol?L-1 |
| 在苯中,2HA?(HA)2 | K2 | △H2 | 4.0×10-3mol?L-1 |
| c[(HA)2] |
| c2(HA) |
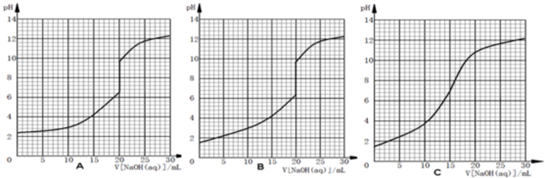
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、一定条件下,C12可在甲苯的苯环或侧链上发生取代反应 |
B、2-甲基丙烯的结构简式: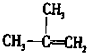 |
| C、乙醇和乙烯的混合物l mol,完全燃烧消耗3 mol O2 |
| D、光照下2,2-二甲基丁烷与Br2反应,其一溴取代物只有2种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com