
| A. | 增加铁的量 | |
| B. | 将容器的体积缩小一半 | |
| C. | 压强不变,充入氮气使容器体积增大 | |
| D. | 加入催化剂 |
分析 对于3Fe(s)+4H2O(g)?Fe3O4(s)+4H2(g)来说,增大压强、浓度、升高温度以及增大固体的表面积,都可增大反应速率,以此解答.
解答 解:A.固体没有浓度,故增加铁的量对平衡无影响,故A正确;
B.将容器的体积缩小一半,所有物质的浓度增大一倍,反应速率加快,故B错误;
C.压强不变,充入氮气使容器体积增大,但所有物质的浓度减小,反应速率变小,故C错误;
D.加入催化剂,可增大反应速率,故D错误.
故选A.
点评 本题考查化学反应速率,为高频考点,侧重于学生的分析能力和基本理论、概念的综合理解和运用的考查,难度不大,注意相关基础知识的积累,易错点为C,注意压强与浓度的关系.


科目:高中化学 来源: 题型:解答题
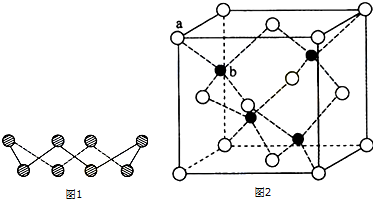
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用水鉴别乙醇、甲苯和溴苯 | |
| B. | 用燃烧法鉴别乙醇、苯 | |
| C. | 用碳酸钠溶液鉴别乙醇、乙酸和乙酸乙酯 | |
| D. | 用酸性高锰酸钾溶液鉴别苯、环己烯和环己烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
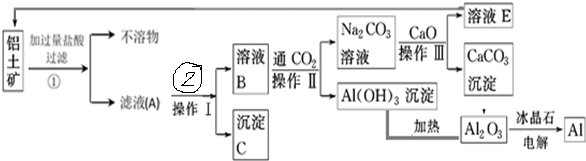
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③⑥ | B. | ②④⑤ | C. | ①②⑤ | D. | ②③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| 元素 | 相关信息 |
| A | 在常温、常压下,其单质是气体,随着人类对环境的认识和要求的提高,它将成为备受青睐的清洁燃料 |
| B | 工业上通过分离液态空气获得其单质,其某种同素异形体是保护地球地表环境的重要屏障 |
| C | 植物生长三要素之一,它能形成多种氧化物,其中一种是早期医疗中使用的麻醉剂 |
| D | 室温下其单质为淡黄色粉末状固体,加热易熔化.该单质在氧气中燃烧,发出明亮的蓝紫色火焰 |
| E | 它在地壳中储量丰富,是人体不可缺少的微量元素之一.其单质为银白色固体,是工农业生产中不可或缺的金属材料,常用于机械制备、建筑等行业 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油裂解可以得到氯乙烯 | |
| B. | 油脂水解可得到氨基酸和甘油 | |
| C. | 所有烷烃和蛋白质中都存在碳碳单键 | |
| D. | 蔗糖和麦芽糖的组成都是C12H22O11,水解产物均含有葡萄糖 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除①③⑤外 | B. | 除②④外 | C. | 除①⑥⑦外 | D. | 除②④⑦外 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com