
【题目】某班同学用如下实验探究Fe2+、Fe3+的性质。请回答下列问题:
(1)甲组同学取l0mL0.l mol·L-1KI溶液,加入6 mL0.l mol·L-1 FeCl3溶液混合。分别取2 mL此溶液于3支试管中进行如下实验:
①第一支试管中加入lmLCCl4充分振荡、静置, CCl4层显紫色;
②第二支试管中加入1滴K3[Fe(CN)6]溶液,生成蓝色沉淀:
③第三支试行中加入1滴KSCN溶液,溶液变红。
实验②检验的离子是(填离子符号) ______________;实验①和③说明:在I-过量的情况下,溶液中仍含有(填离子符号)_______________,由此可以证明该氧化还原反应为___________________(填可逆反应或不可逆反应)。
(2)乙组同学向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液变成棕黄色,发生反应的离子方程式为____________________________;一段时间后,溶液中有气泡出现,并放热,随后有红褐色沉淀生成。产生气泡的原因是__________________________________;生成沉淀的原因是(用平衡移动原理解释)_________________________________________________。
(3)丙组同学模拟工业上用NaClO3氧化酸性FeCl2废液制备FeCl3。
①若酸性FeCl2 废液中:c(Fe2+)=2.0×10-2 mol·L-1,c(Fe3+)=1.0×10-3 mol·L-1,c(Cl-)=5.3×10-2 mol·L-1,则该溶液的pH约为_____________。
②完成NaClO3氧化FeCl2的离子方程式:□ClO3-+□Fe2++□________=□Cl-+□Fe3++□________。
【答案】Fe2+ Fe3+可逆反应2Fe2++H2O2+2H+=2Fe3++2H2OFe3+催化H2O2分解产生O2H2O2分解反应放热,促进Fe3+的水解平衡正向移动21 6 6H+ 1 6 3H2O
【解析】
(1) 加入1滴K3[Fe(CN)6]溶液,生成蓝色沉淀是亚铁离子的检验特征反应现象,加入1滴KSCN溶液,溶液变红是铁离子的检验特征反应现象;反应最后Fe2+、Fe3+、I-、I2共存。(2)向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液变成棕黄色,说明Fe2+被H2O2氧化为 Fe3+。Fe3+能催化H2O2分解;H2O2分解反应放热,温度升高促进Fe3+的水解。(3)①根据电荷守恒计算氢离子浓度;②根据得失电子守恒、电荷守恒配平离子方程式。
(1) 加入1滴K3[Fe(CN)6]溶液,生成蓝色沉淀是亚铁离子的检验特征反应现象,实验②检验的离子是Fe2+,加入1滴KSCN溶液,溶液变红是铁离子的检验特征反应现象,实验①和③说明:在I-过量的情况下,溶液中仍含有Fe3+;反应最后Fe2+、Fe3+、I-、I2共存,说明该反应是可逆反应。(2)向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液变成棕黄色,说明Fe2+被H2O2氧化为 Fe3+,反应离子方程式是2Fe2++H2O2+2H+=2Fe3++2H2O。Fe3+能催化H2O2分解放出氧气,所以一段时间后,溶液中有气泡出现;H2O2分解反应放热,温度升高促进Fe3+的水解平衡正向移动,所以有红褐色氢氧化铁沉淀生成。(3)①根据电荷守恒, 2c(Fe2+)+3c(Fe3+) +c(H+)= c(Cl-), c(H+)= c(Cl-)-2c(Fe2+)-3c(Fe3+)= 5.3×10-2 mol·L-1-2.0×10-2 mol·L-1![]() -1.0×10-3 mol·L-1
-1.0×10-3 mol·L-1![]() =1.0×10-2 mol·L-1,所以pH=2;②根据得失电子守恒、电荷守恒NaClO3氧化FeCl2的离子方程式是 1 ClO3-+ 6 Fe2++ 6H+ = 1 Cl-+ 6 Fe3++3H2O。
=1.0×10-2 mol·L-1,所以pH=2;②根据得失电子守恒、电荷守恒NaClO3氧化FeCl2的离子方程式是 1 ClO3-+ 6 Fe2++ 6H+ = 1 Cl-+ 6 Fe3++3H2O。


 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案科目:高中化学 来源: 题型:
【题目】下列实验操作对应的实验现象及解释或结论都正确的是( )
选项 | 实验操作 | 实验现象 | 解释或结论 |
A | 向Fe(NO3)2溶液中滴入硫酸酸化的H2O2溶液 | 溶液变为黄色 | 氧化性:H2O2>Fe3+ |
B | 向5mL1mol/L NaOH溶液中滴加5滴1mol/L MgCl2溶液,然后再滴加足量的1mol/L CuCl2溶液 | 先产生白色沉淀,然后产生蓝色沉淀 | Ksp[Cu(OH)2] >Ksp[Mg(OH)2] |
C | 将充满NO2的密闭玻璃球浸泡在热水中 | 红棕色变深 | 2NO2(g) |
D | 向一定量酸性KMnO4溶液中加入乙二醇(HOCH2CH2OH) | 溶液紫色褪去 | 乙二醇被氧化为乙二酸 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应既是氧化还原反应,又是反应物总能量低于生成物总能量的是
A.铝与稀盐酸的反应B.Ba(OH)2·8H2O与NH4Cl的反应
C.灼热的碳与二氧化碳的反应D.甲烷在氧气中的燃烧反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,正确的是:
①需要加热才能发生的反应一定是吸热反应;②放热反应在常温下一定很容易发生;③一个化学反应是放热反应还是吸热反应,必须看反应物和生成物所具有的总能量的相对大小;④有的吸热反应在常温下也能发生。
A.①②③④B.①②C.②③④D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A. 由水电离出的c(H+)=10-12mol·L-1的溶液中:Mg2+、K+、Br-、HCO3-
B. 含有大量Fe3+的溶液:Na+、Mg2+、NO3-、SCN-
C. 含有大量NO3-的溶液:H+、Fe2+、SO42-、Cl-
D. 使酚酞变红色的溶液:Na+、Ba2+、NO3-、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是

A.图1表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为241.8 kJ·mol-1
B.图2表示压强对可逆反应2A(g)+2 B(g)![]() 3C(g)+D(s)的影响,乙的压强比甲的压强大
3C(g)+D(s)的影响,乙的压强比甲的压强大
C.图3表示等质量的钾、钠分别与足量水反应,则甲为钠
D.图4表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则相同条件下NaA溶液的pH大于同浓度的NaB溶液的pH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度压强下,用mg的CH4、CO2、O2、SO2四种气体分别吹出四个体积大小不同的气球,下列说法中正确的是( )
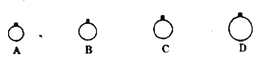
A.气球B中装的是O2
B.气球A和气球C中气体分子数相等
C.气球A和气球D中气体物质的量之比为4:1
D.气球C和气球D中气体密度之比为2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对工业废水和生活污水进行处理是防止水体污染、改善水质的主要措施之一。
(1)硫酸厂的酸性废水中砷(As)元素(主要以H3AsO3形式存在)含量极高,为控制砷的排放,某工厂采用化学沉淀法处理含砷废水。请回答以下问题:
①已知砷是氮的同族元素,比氮原子多2个电子层,砷在元素周期表的位置为____________。
②工业上采用硫化法(通常用硫化钠)去除废水中的砷,生成物为难溶性的三硫化二砷,该反应的离子方程式为_____________________。
(2)电镀厂的废水中含有的CN-有剧毒,需要处理加以排放。处理含CN-废水的方法之一是在微生物的作用下,CN-被氧气氧化成HCO3-,同时生成NH3,该反应的离子方程式为_____________。
(3)电渗析法处理厨房垃极发酵液,同时得到乳酸的原理如图所示(图中“HA”表示乳酸分子,A-表示乳酸根离子):
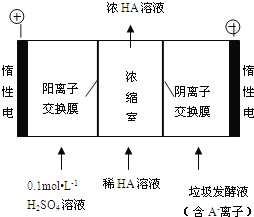
①阳极的电极反应式为________________________。
②简述浓缩室中得到浓乳酸的原理:________________________。
③电解过程中,采取一定的措施可控制阳极室的pH约为6~8,此时进入浓缩室的OH-可忽略不计。400 mL 10 g/L 乳酸溶液通电一段时间后,浓度上升为145 g/L(溶液体积变化忽略不计),阴极上产生的H2在标准状况下的体积约为________L(提示:乳酸的摩尔质量为90 g/mol)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com