
【题目】已知元素的电负性和原子半径一样,也是元素的基本性质。下表给出14种元素的电负性:
元素 | AL | B | Be | C | Cl | F | Li | Mg | N | Na | O | P | S | Si |
电负性 | 1.5 | 2.0 | 1.5 | 2.5 | 3.0 | 4.0 | 1.0 | 1.2 | 3.0 | 0.9 | 3.5 | 2.1 | 2.5 | 1.8 |
试结合元素周期律相关知识完成下列问题。
(1)根据上表给出的数据,可推知元素的电负性具有的变化规律是__________ (从电负性与结构的关系考虑)。
(2)请预测Br与I元素电负性的大小关系:_________ 。
(3)经验规律告诉我们:当成键的两原子相应元素的电负性差值大于1.7时,一般为离子键,而小于1.7时,一般为共价键。试推断![]() 中化学键的类型是 ___________
中化学键的类型是 ___________
(4)预测元素周期表中电负性最小的元素是_____ (放射性元素除外)。
【答案】同周期元素随核电荷数的递增,元素电负性依次增大,同主族元素随核电荷数的递增,元素电负性依次减小 Br>I 共价键 Cs
【解析】
(1)结合表格中的数据,从周期和族两个方面总结规律;
(2)根据电负性变化规律分析;
(3)Cl和Al的电负性之差为1.5,小于1.7,故AlCl3中的化学键为共价键。
(4)电负性较小的元素位于元素周期表的左下方。
(1)由表中数据可知,第二周期元素从Li~F,随着原子序数的递增,元素的电负性逐渐增大,第三周期元素从Na~S,随着原子序数的递增,元素的电负性也逐渐增大,并呈周期性变化;同主族元素,元素随核电荷数的递增,元素电负性依次减小;
(2)根据电负性变化规律,同主族元素,元素随核电荷数的递增,元素电负性依次减小Br的电负性大于I的电负性;
(3)当成键的两原子相应元素的电负性差值大于1.7时,一般为离子键,而小于1.7时,一般为共价键。结合表格数据,Cl和Al的电负性之差为1.5,小于1.7,故AlCl3中的化学键为共价键;
(4)电负性较小的元素位于元素周期表的左下方,放射性元素除外,电负性最小的元素是Cs。


科目:高中化学 来源: 题型:
【题目】按要求填空。
(1)![]() 的核外电子排布式:________________________ 。
的核外电子排布式:________________________ 。
(2)![]() 的价电子排布式:________________________ 。
的价电子排布式:________________________ 。
(3)![]() 的电子式:________________________ 。
的电子式:________________________ 。
(4)![]() 的价电子轨道表示式: ________________________ 。
的价电子轨道表示式: ________________________ 。
(5)![]() 的原子结构示意图: ________________________ 。
的原子结构示意图: ________________________ 。
(6)第四周期中最外层只有1个电子的所有基态原子的简化电子排布式:________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在T℃下,向装有5mL0.005mol.L-1FeCl3溶液的试管中加入5mL0.01mol·L-1KSCN溶液,发生如下反应:FeCl3+3KSCN![]() Fe(SCN)3+3KCl,溶液呈血红色。下列叙述正确的是( )
Fe(SCN)3+3KCl,溶液呈血红色。下列叙述正确的是( )
A.升高温度,逆反应速率减小
B.加入Fe2(SO4)3固体,溶液血红色加深
C.加入KCl固体,溶液血红色加深
D.增大压强,溶液血红色加深
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验装置的说法中正确的是

A.用图1装置可用于气体的发生、干燥和收集,如铜屑与稀硝酸反应制备NO
B.用图2装置制备Fe(OH)2并能较长时间观察其颜色
C.用图3装置可以验证FeCl3对H2O2分解反应有催化作用
D.用图4装置测量Cu与浓硝酸反应产生气体的体积
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】t ℃时,两种碳酸盐MCO3(M分别为A和B两种离子)的沉淀溶解平衡曲线如图所示。已知:pM=-lg c(M2+),p(CO32-)=-lg c(CO32-)。ACO3比BCO3溶解度更大。(不考虑阴阳离子的水解)。下列说法正确的是

A.线b表示BCO3的溶解平衡曲线
B.该温度下,向ACO3的饱和溶液中加入Na2CO3溶液,一定能产生沉淀
C.t ℃时,ACO3(s)+B2+(aq)![]() BCO3(s)+A2+(aq)平衡常数K=10 0.9
BCO3(s)+A2+(aq)平衡常数K=10 0.9
D.向0.1 L 1 mol/L的BCl2溶液中加入Na2CO3固体,当加入Na2CO3固体的质量为116.6 g时,B2+离子恰好沉淀完全(当B2+离子浓度为10-5 mol/L时认为沉淀完全)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国某科研团队以软锰矿(主要成分是MnO2,含有SiO2、Fe2O3等少量杂质)为主要原料,制取高纯碳酸锰,工艺流程如下图:
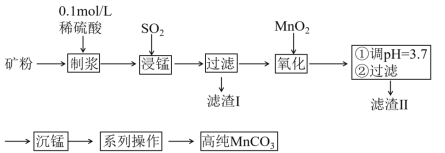
(1)对矿石进行粉粹的目的是_______;
(2)滤渣Ⅰ、Ⅱ分别为________、________;
(3)采用1%稀硫酸而不采用水混合矿粉制浆的原因是_________;不采用较浓H2SO4的原因是______;不直接采用H2SO4浸锰的原因是___________。
(4)浸锰的离子方程式为____________;
(5)“系列操作”为过滤、_________、干燥。
(6)取所得的高纯MnCO311.7g溶于足量的盐酸中,将产生的气体用足量的Ba(OH)2浓溶液吸收,得到白色沉淀19.7g,则所得产品的纯度为________%(保留一位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】位于不同主族的四种短周期元素甲、乙、丙、丁,其原子序数依次增大,原子半径r(丁)>r(乙)>r(丙)>r(甲)。四种元素中,只有一种为金属元素,乙和丙原子的最外层电子数之和为丁原子的最外层电子数的3倍。据此推断,下述正确的是
A.简单氢化物的沸点:乙>丙
B.由甲、乙两元素组成的化合物溶于水呈碱性
C.丙和丁两元素的最高价氧化物的水化物之间能发生反应
D.由甲和丙两元素组成的分子,不可能含非极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A.1 mol·L-1AlCl3溶液中含有的Al3+数目小于NA
B.标准状况下,11 g 3H216O中含有的质子数目为6NA
C.1 mol Li2O和Na2O2的混合物中含有的离子总数大于3NA
D.常温常压下,4.6 g NO2所含的氮原子数目为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用 NA 表示阿伏加德罗常数,下列说法正确的是
A.用氢氧燃料电池电解饱和食盐水得到 0.4mol NaOH,在燃料电池的负极上消耗氧气分子数为 0.1 NA
B.2 mol H3O+中含有的电子数为 20 NA
C.密闭容器中 1 mol N2(g)与 3 mol H2 (g)反应制备氨气,形成 6 NA 个 N-H 键
D.32 g N2H4中含有的共用电子对数为6 NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com