
(14分)某兴趣小组同学在实验室用加热1-丁醇、浓H2SO4和溴化钠混合物的方法来制备1-溴丁烷,并检验反应的部分副产物,设计了如图所示装置,其中夹持仪器、加热仪器及冷却水管没有画出。

请根据实验步骤,回答下列问题:
(1)关闭a和b、接通竖直冷凝管的冷凝水,给A加热30分钟,制备1-溴丁烷。
竖直冷凝管接通冷凝水,进水口是_____(填“I”或“Ⅱ”);冷凝回流的主要目的是________。
(2)理论上,上述反应的副产物可能有:丁醚(CH3CH2CH2CH2-O-CH2CH2CH2CH3)、1-丁烯、溴化氢、硫酸氢钠、水等。熄灭酒精灯,在竖直冷凝管上方塞上塞子并打开a,利用余热继续反应直至冷却,通过B、C装置检验部分副产物。
B、C中应盛放的试剂分别是_________和 ,写出C装置中主要的化学方程式:_______________。
(3)为了进一步分离提纯1-溴丁烷,该兴趣小组同学查得相关有机物的数据如表所示:
物质 | 熔点/℃ | 沸点/℃ |
1-丁醇 | -89.5 | 117.3 |
1-溴丁烷 | -112.4 | 101.6 |
丁醚 | -95.3 | 142.4 |
1-丁烯 | -185.3 | -6.5 |
请你补充下列实验步骤,直到分离出1-溴丁烷。
①待烧瓶冷却后,拔去竖直的冷凝管;
②_______;③_______;④_______;⑤_______,收集所得馏分。
(4)若实验中所取1-丁醇、NaBr分别为7.4 g、13.0 g,蒸出的粗产物经洗涤、干燥后再次蒸馏得到9.6 g1-溴丁烷,则1-溴丁烷的产率是_____。(保留2位有效数字)
(14分)
(1)Ⅱ(2分) 充分反应,提高反应物的转化率(2分)
(2)碳酸氢钠溶液(1分,其他合理答案均可)、溴水(1分,其他合理答案均可)
CH3CH2CH= CH2+Br2→BrCH2CHBrCH2CH3(2分)
(3)②插上带橡皮塞的温度计(1分) ③关闭a,打开b (1分)
④接通冷凝管的冷凝水,使冷水从d处流入(1分)
⑤迅速升高温度至101.6℃(1分)
(4)70%(2分)
【解析】
试题分析:(1)为使冷凝效果好,所以水从下端进入从上端出,所以进水口是II;因为1-丁醇的沸点与1-溴丁烷的沸点都较低,易挥发,所以冷凝的目的是使1-丁醇更好的转化为生成物,提高反应物的转化率;
(2)根据醋酸的副产物,其中的1-丁烯、溴化氢易挥发,所以可检验1-丁烯、溴化氢,检验烯烃所用试剂一般是溴水,而溴水中也存在HBr,所以先检验HBr,再检验1-丁烯,检验HBr可用硝酸银溶液、石蕊试液、碳酸氢钠溶液等,检验1-丁烯用溴水即可,所以B中的试剂是硝酸银溶液、石蕊试液、碳酸氢钠溶液等,C中的试剂是溴水;溴与1-丁烯发生加成反应,生成1,2-二溴丁烷,化学方程式为CH3CH2CH= CH2+Br2→BrCH2CHBrCH2CH3;
(3)为了进一步分离提纯1-溴丁烷,根据物质的沸点的不同,采用蒸馏的装置可分离提纯1-溴丁烷,所以实验步骤是将该装置改为蒸馏装置。②插上带橡皮塞的温度计 ,用来测量馏分的温度;③关闭a,打开b ,形成蒸馏装置;④接通冷凝管的冷凝水,使冷水从d处流入,增强冷凝效果;⑤迅速升高温度至101.6℃,收取到的馏分即为1-溴丁烷。
(4)1-丁醇、NaBr反应的化学方程式是CH3CH2CH2CH2OH+NaBr→CH3CH2CH2CH2Br+NaOH,7.4 g1-丁醇的物质的量是7.4g/74g/mol=0.1mol,13.0 gNaBr的物质的量是10.3g/103g/mol=0.1mol,则理论上生成1-溴丁烷的质量是0.1mol×137g/mol=13.7g,而实际得到9.6 g1-溴丁烷,则1-溴丁烷的产率是9.6g/13.7g×100%=70%。
考点:考查有机物的制取实验分析,反应原理的判断,物质的检验,产率的计算


科目:高中化学 来源:2014-2015学年上海市嘉定区高三一模化学试卷(解析版) 题型:选择题
在已经处于化学平衡状态的体系中,如果下列量发生变化,其中一定能表明平衡已经发生移动的是
A.反应混合物的浓度 B.反应物的转化率
C.正、逆反应速率 D.反应混合物的压强
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市长宁区高三上学期教学质量检测化学试卷(解析版) 题型:填空题
(本题共12分)大约100年前,德国化学家哈伯(F.Haber)开始研究由氮气和氢气合成氨。一种工业合成氨的简易流程图如下:
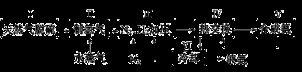
28.天然气中的H2S杂质常用氨水吸收,产物为NH4HS。一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式:___________________________________________。
29.工业上可用组成为K2O·M2O3·2RO2·nH2O的无机材料纯化含某些杂质的原料氢气。已知元素M、R均位于元素周期表中第3周期,两种元素原子的质子数之和为27。R原子核外电子有_____种不同运动状态,最外层的p电子有_______种自旋方向。
30.常温下,不能与M单质发生反应的是_________(填序号)
A.CuSO4溶液
B.Fe2O3
C.浓硫酸
D.NaOH溶液
E.Na2CO3固体
步骤Ⅱ中制氢气原理如下:
①CH4(g)+H2O(g)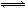 CO(g)+3H2(g)- 206.4 kJ
CO(g)+3H2(g)- 206.4 kJ
②CO(g)+H2O(g)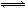 CO2(g)+H2(g)+ 41.2 kJ
CO2(g)+H2(g)+ 41.2 kJ
31.对于反应①,一定可以提高平衡体系中H2百分含量,又能加快反应速率的措施是 。
A.升高温度 B.增大水蒸气浓度 C.加入催化剂 D.降低压强
32.利用反应②,将CO进一步转化,可提高H2产量。若1 mol CO和H2的混合气体(CO的体积分数为20%)与H2O反应,得到1.18 mol CO、CO2和H2的混合气体,则CO转化率为__________。
33.依据温度对合成氨反应的影响,在下图坐标系中,画出一定条件下的密闭容器内,从通入原料气开始,随温度不断升高,NH3物质的量变化的曲线示意图。

查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市长宁区高三上学期教学质量检测化学试卷(解析版) 题型:选择题
以下关于煤与石油化工的认识不正确的是
A.分子中含18个碳原子以上烷烃的重油经过催化裂化可以得到汽油
B.氧化铝粉末可以提高石蜡裂化的效率
C.塑料、橡胶、纤维都是石油化工的产品
D.植物油和裂化汽油都含有不饱和碳原子
查看答案和解析>>
科目:高中化学 来源:2014-2015学年陕西省五校高三第一次模拟联考理综化学试卷(解析版) 题型:填空题
【化学——选修5:有机化学基础】(15分)
有机物丙(C13H18O2)是一种香料,其合成路线如图所示。其中A的相对分子质量通过质谱法测得为56,它的核磁共振氢谱显示只有两组峰;D可以发生银镜反应,在催化剂存在条件下1 mol D与2 mol H2反应可以生成乙;丙中含有两个-CH3
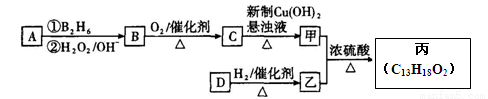

(1)A的结构简式为 ;乙的分子式为 。
(2)C与新制Cu(OH)2悬浊液反应的化学方程式_________________。
(3)D所含官能团的名称是 ;D有多种同分异构体,其中与其所含官能团相同的同分异构体有 种(不考虑立体异构)。
(4)甲与乙反应的化学方程式为 。
(5)写出满足下列条件的有机物的结构简式 ⅰ与乙互为同分异构体;ⅱ遇FeCl3溶液显紫色;ⅲ其苯环上的一溴代物只有两种。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年陕西省五校高三第一次模拟联考理综化学试卷(解析版) 题型:选择题
对于实验I?IV的描述正确的是

A.实验I :逐滴滴加稀盐酸时,试管中立即产生大量气泡
B.实验II:充分振荡后静置,下层溶液为橙红色,上层无色
C.实验III:从饱和食盐水中提取NaCl晶体
D.装置IV:酸性KMnO4溶液中有气泡出现,且溶液颜色逐渐变浅乃至褪去
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山西省等四校高三第二次联考化学试卷(解析版) 题型:填空题
(8分)近年来燃煤脱硫技术受到各界科研人员的重视,某脱硫技术涉及如下反应:
I CaSO4(s)+ CO(g) CaO(s)+SO2(g)+CO2(g) △H1=+218.4 kJ·mol-l
CaO(s)+SO2(g)+CO2(g) △H1=+218.4 kJ·mol-l
II CaO(s) +3CO(g)+SO2(g) CaS(s)+3CO2(g) △H2=-394.0 kJ·mol-l
CaS(s)+3CO2(g) △H2=-394.0 kJ·mol-l
(1)若用K1、K2分别表示反应I、II的化学平衡常数,则反应1/2CaSO4(s)+2CO(g) 1/2CaS(s)+2CO2(g)的平衡常数K=_________(用含K1、K2的式子表示)
1/2CaS(s)+2CO2(g)的平衡常数K=_________(用含K1、K2的式子表示)
(2)某温度下在一密闭容器中若只发生反应I,测得数据如下:
t/s | 0 | 10 | 20 | 30 | 50 |
c(CO)mol/L | 3 | 1.8 | 1.2 | 0.9 | 0.9 |
前20 s 内v(SO2)=__________mo1·L-l·s-l,平衡时CO的转化率为__________。
(3)某科研小组研究在其它条件不变的情况下,改变起始一氧化碳物质的量,对反应IICaO(s) +3CO(g) +SO2 (g) CaS(s)+3CO2(g)的影响,实验结果如图所示(图中T表示温度):
CaS(s)+3CO2(g)的影响,实验结果如图所示(图中T表示温度):

①比较在a、b、c三点所处的平衡状态中,反应物SO2的转化率最高的是_______________。
②图像中T2_____T1(填“高于”、“低于”、“等于”或 “无法确定”)判断的理由是____________________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山西省等四校高三第二次联考化学试卷(解析版) 题型:选择题
下列说法正确的是
A.塑化剂DEHP是指邻苯二甲酸二(2─乙基己)酯,对人体无害,可用作食品添加剂
B.二氧化氮经过加压凝成无色液体为物理变化
C.Na2O·SiO2是一种简单的硅酸盐,可溶于水
D.为测定熔融氢氧化钠的导电性,可将氢氧化钠固体放在石英坩埚中加热熔化
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省高三1月检测化学试卷(解析版) 题型:选择题
常温下,下列各组离子在指定溶液中能大量共存的是
A.pH=1的溶液中:Fe2+、NO3-、SO42-、Na+
B.由水电离的c(H+)=1×10-14 mol·L-1的溶液中:Ca2+、K+、Cl-、HCO3-
C.c(H+)/c(OH-)=1012的溶液中:NH4+、Al3+、NO3-、Cl-
D.c(Fe3+)=0.1 mol·L-1的溶液中:K+、ClO-、SO42-、SCN-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com