
【题目】工业废弃物的资源化回收再利用,可以更大限度地发挥原材料的价值。下图是工业生产纳米磁性氧化铁的流程:
![]()
![]()
![]()
![]()
![]()
![]()
![]()
下列说法不正确的是
A.用Na2CO3溶液浸泡是为了除去废铁屑表面的油污
B.若生产中不通入N2,暴露在空气中生产,将不能得到高纯度产品
C.加适量的H2O2是为了将部分Fe2+氧化为Fe3+ ,涉及的反应:H2O2+2Fe2++2H+=2Fe3++2H2O
D.溶液A中Fe2+和Fe3+的浓度比为2∶1
【答案】D
【解析】
根据题中磁性氧化铁的流程可知,本题考查四氧化三铁中铁离子和亚铁离子的性质,运用铁离子和亚铁离子的转换方法进行分析。
A. 碳酸钠是强碱弱酸盐水解呈碱性,浸泡废铁屑可以使表面的油脂水解除去,而不能除铁锈,A项正确;
B. 若生成中不通入氮气,暴露在空气中,亚铁离子会被氧化成铁离子,将不能得到高纯度的产品,B项正确;
C. 加入过氧化氢是将亚铁离子氧化成铁离子,1molH2O2得到2mol的电子,所以反应的离子方程式为H2O2+2Fe2++2H+═2Fe3++2H2O,C项正确;
D. 根据最终产物为四氧化三铁,其中Fe2+和Fe3+的数目之比为1:2,所以溶液A中Fe2+和Fe3+的浓度比为1:2,D项错误;
答案选D。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】工业上常用CO和H2合成甲醇,反应方程式为:
CO (g) +2H2 (g) ![]() CH3OH (g) △H,在T1℃时,体积为2L的恒容容器中充入物质的量之和为3mol的H2和CO,达到平衡时CH3OH的体积分数(V%)与n(H2):n(CO)的关系如图1所示。
CH3OH (g) △H,在T1℃时,体积为2L的恒容容器中充入物质的量之和为3mol的H2和CO,达到平衡时CH3OH的体积分数(V%)与n(H2):n(CO)的关系如图1所示。
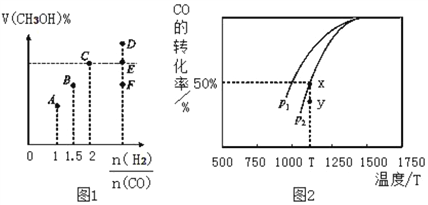
(1)当起始n (H2):n(CO) =2,经过5min达到平衡,此时容器的压强是初始压强的0.7倍,则0~5min内平均反应速率v(H2)=____。若此时再向容器中加入0.15 mol CO (g)和0.05 mol CH3OH (g),达新平衡时H2的转化率将_______(选填“增大”、“减小”或“不变”)。
(2)当起始n (H2):n(CO) =3.5时,达到平衡状态后,CH3OH的体积分数可能是图象中的_____点(选填“D”、“E”或“F”)。
(3)由图2可知该反应的△H_____0(选填“>”、“<”或“=”,下同),压强pl____p2;当压强为p2时,在y点:v(正)____v(逆)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠![]() 是重要漂白剂.探究小组开展如下实验,回答下列问题:
是重要漂白剂.探究小组开展如下实验,回答下列问题:
实验Ⅰ:制取![]() 晶体按如图装置进行制取。
晶体按如图装置进行制取。

已知:![]() 饱和溶液在低于
饱和溶液在低于![]() 时析出
时析出![]() ,高于
,高于![]() 时析出
时析出![]() ,高于
,高于![]() 时
时![]() 分解成
分解成![]() 和NaCl.
和NaCl.
(1)用![]() 双氧水配制
双氧水配制![]() 的
的![]() 溶液,需要的玻璃仪器除玻璃棒、胶头滴管、烧杯外,还需要______
溶液,需要的玻璃仪器除玻璃棒、胶头滴管、烧杯外,还需要______![]() 填仪器名称
填仪器名称![]() ;
;
(2)装置C的作用是______;
(3)装置B内生成的![]() 气体与装置D中混合溶液反应生成
气体与装置D中混合溶液反应生成![]() ,生成
,生成![]() 的反应方程式为______.
的反应方程式为______.
(4)如果撤去D中的冷水浴,可能导致产品中混有的杂质是______;
(5)反应后,经以下步骤可从装置D的溶液获得![]() 晶体.请补充完整操作iii.
晶体.请补充完整操作iii.
![]() 蒸发结晶;
蒸发结晶;![]() 趁热过滤;iii.______;
趁热过滤;iii.______;![]() 低于
低于![]() 干燥,得到成品.
干燥,得到成品.
实验Ⅱ:样品杂质分析与纯度测定
(6)上述实验制得的![]() 晶体中含少量
晶体中含少量![]() 。产生
。产生![]() 最可能的原因是______;
最可能的原因是______;
![]() 中有
中有![]() 气体产生,并有部分进入D装置内
气体产生,并有部分进入D装置内
![]() 中浓硫酸挥发进入D中与NaOH中和
中浓硫酸挥发进入D中与NaOH中和
![]() 中的硫酸钠进入到D装置内
中的硫酸钠进入到D装置内
(7)测定样品中![]() 的纯度。测定时进行如下实验:
的纯度。测定时进行如下实验:
准确称一定质量的样品,加入适量蒸馏水和过量的KI晶体,在酸性条件下发生如下反应:![]() ,将所得混合液稀释成100mL待测溶液。
,将所得混合液稀释成100mL待测溶液。
取![]() 待测溶液,加入淀粉溶液做指示剂,用c
待测溶液,加入淀粉溶液做指示剂,用c![]()
![]() 标准液滴定至终点,测得消耗标准溶液体积的平均值为V
标准液滴定至终点,测得消耗标准溶液体积的平均值为V![]() 已知:
已知:![]()
![]() 确认滴定终点的现象是______;
确认滴定终点的现象是______;
![]() 所称取的样品中
所称取的样品中![]() 的物质的量为______
的物质的量为______![]() 用含c、V的代数式表示
用含c、V的代数式表示![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应N2+3H2![]() 2NH3的正逆反应速率可用各反应物或生成物浓度的变化来表示。下列关系中能说明反应已达到平衡状态的是( )
2NH3的正逆反应速率可用各反应物或生成物浓度的变化来表示。下列关系中能说明反应已达到平衡状态的是( )
A.v正(N2)=v逆(NH3)B.3v正(N2)=v正(H2)
C.2v正(H2)=3v逆(NH3)D.v正(N2)=3v逆(H2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铋![]() 及其化合物广泛应用于电子、医药等领域。由辉铋矿(主要成分为
及其化合物广泛应用于电子、医药等领域。由辉铋矿(主要成分为![]() ,含杂质
,含杂质![]() 、
、![]() 等)制备
等)制备![]() 的工艺如下(已知水解能力:
的工艺如下(已知水解能力:![]() )
)
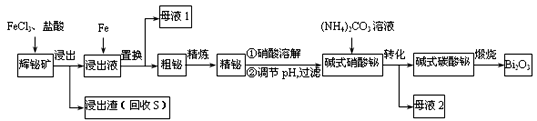
回答下列问题:
(1)为了提高浸出率,可采取的措施有_______________。(任写一条)
(2)“浸出”时![]() 与
与![]() 溶液反应的化学方程式为__________________________,盐酸的作用_________________________________________。
溶液反应的化学方程式为__________________________,盐酸的作用_________________________________________。
(3)“母液2”中主要溶质的化学式为________。
(4)“粗铋”中含有的主要杂质是Pb,可通过电解精炼除杂。电解质为熔融![]() 、KC1,电解后精铋留在粗铋电极下方电解槽底部。电解时,粗铋与电源_____(填“正”或“负”)极相连。阴极的电极反应为__________________________,铅元素的金属性比铋元素______。(填“强”“弱”或“不能确定”)。
、KC1,电解后精铋留在粗铋电极下方电解槽底部。电解时,粗铋与电源_____(填“正”或“负”)极相连。阴极的电极反应为__________________________,铅元素的金属性比铋元素______。(填“强”“弱”或“不能确定”)。
(5)碱式硝酸铋直接灼烧也能得到![]() ,上述工艺中转化为碱式碳酸铋再灼烧的优点是_________。
,上述工艺中转化为碱式碳酸铋再灼烧的优点是_________。
(6)常温下,向浓度均为![]() 的
的![]() 、
、![]() 的混合溶液中滴加
的混合溶液中滴加![]() 溶液,先生成__________沉淀,通过计算说明______________________________。[已知:Ksp(PbS) = 3.0×10-28,Ksp(Bi2S3) = 1.0×10-20]
溶液,先生成__________沉淀,通过计算说明______________________________。[已知:Ksp(PbS) = 3.0×10-28,Ksp(Bi2S3) = 1.0×10-20]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.油脂水解可得到氨基酸和甘油
B.结构片段![]() 的高聚物,其单体是苯酚和甲醛
的高聚物,其单体是苯酚和甲醛
C.检验淀粉在稀硫酸条件下水解产物的方法是:取适量水解液于试管中,加入少量新制 Cu(OH)2 悬浊液,加热,观察是否有砖红色沉淀
D.鸡蛋清溶液中加入饱和硫酸铵溶液、饱和硫酸铜溶液均会发生盐析而凝聚
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将10 g Fe2O3、SiO2、Al2O3的混合物加入足量的100 mL x mol/L稀硫酸中,过滤,然后加入10 mol/L NaOH溶液,产生沉淀的质量和加入NaOH溶液的体积关系如图所示。下列叙述错误的是

A.滤出的物质为SiO2
B.可求出x的值
C.可求出Al2O3的质量分数
D.可求出Fe2O3的质量分数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用一定量的铁与足量的CuO制单质铜,有人设计了以下两种方案:

若按实验原则进行操作,则两者制得单质铜的量为 ( )
A.一样多B.①多C.②多D.无法判断
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com