
���� ��1��c��Na2CO3��=$\frac{1}{2}$c��Na+����m��Na2CO3��=n��Na2CO3��•M��Na2CO3�������м��㣻
��2��n��MgCl2��=$\frac{1.806��1{0}^{24}}{6.02��1{0}^{23}}$��$\frac{1}{3}$=1 mol��
��c��MgCl2��=$\frac{1mol}{100��1{0}^{-3}L}$=10 mol/L��
��c��Cl-��=2 c��MgCl2��=2��10 mol/L=20 mol/L��
��3������n=$\frac{m}{M}$����������ӵ����ʵ�����Ȼ�����������������ʵ�����������c=$\frac{n}{V}$������������������
��4��n��Na2SO4��=c��Na2SO4��•V����Һ��=1 mol/L��200��10-3L=0.2mol
m��Na2SO4��=n��Na2SO4��•M��Na2SO4��=0.2 mol��142g/mol=28.4g������n=$\frac{m}{M}$��c=$\frac{n}{V}$���㣮
��� �⣺��1��c��Na2CO3��=$\frac{1}{2}$c��Na+��=$\frac{1}{2}$��0.8 mol/L=0.4 mol/L��n��Na2CO3��=c��Na2CO3��•V����Һ��=0.4 mol/L��100��10-3L=0.04mol��m��Na2CO3��=n��Na2CO3��•M��Na2CO3��=0.04 mol��106g/mol=4.24 g���ʴ�Ϊ��4.24��
��2��n��MgCl2��=$\frac{1.806��1{0}^{24}}{6.02��1{0}^{23}}$��$\frac{1}{3}$=1 mol��
��c��MgCl2��=$\frac{1mol}{100��1{0}^{-3}L}$=10 mol/L��
��c��Cl-��=2 c��MgCl2��=2��10 mol/L=20 mol/L��
�ʴ�Ϊ��10 mol/L��20 mol/L��
��3��n[Al2��SO4��3]=$\frac{1}{2}$n��Al3+��=$\frac{1}{2}$��$\frac{27}{27}$=0.5mol��
V��Al2��SO4��3��Һ��=n[Al2��SO4��3]��c[Al2��SO4��3]=$\frac{0.5mol}{6.25mol/L}$=0.08L=80ml��
�ʴ�Ϊ��80��
��4��n��Na2SO4��=c��Na2SO4��•V����Һ��=1 mol/L��200��10-3L=0.2mol
��m��Na2SO4��=n��Na2SO4��•M��Na2SO4��=0.2 mol��142g/mol=28.4g
n��NaOH��=$\frac{28.4g}{40g/mol}$=0.71 mol��
V��NaOH��Һ��=$\frac{0.71mol}{2mol/L}$=0.355��L��=355ml��
�ʴ�Ϊ��355��
���� ���⿼�������ʵ����ļ��㣬��Ŀ�ѶȲ�����ȷ���ʵ�����Ħ������������Ħ����������ʵ���Ũ�ȵ�֮��Ĺ�ϵΪ���ؼ�������������ѧ���ķ�����������ѧ����������


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
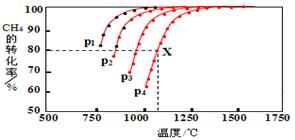 ��Դ�������������������ᷢչ������أ�
��Դ�������������������ᷢչ������أ�| �� �� | �� | �� |
| ��Ӧ��Ͷ���� | 1molCO 2��g����3molH2��g�� | 1molCH3OH��g����1molH2O��g�� |
| ƽ��ʱc��CH3OH�� | c1 | c2 |
| ƽ��ʱ�����仯 | �ų�29.4kJ | ����akJ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ���� | �� | �� | �� |
| ��Ӧ��Ͷ���� | 1mol��N2��3mol��H2 | 2mol��NH3 | 4mol��NH3 |
| NH3��Ũ�ȣ�mol•L-1�� | c1 | c2 | c3 |
| ��Ӧ�������仯 | �ų�akJ | ����bkJ | ����ckJ |
| ��ϵѹǿ��Pa�� | p1 | p2 | p3 |
| ��Ӧ��ת���� | a1 | a2 | a3 |
| A�� | ��1+��3��1 | B�� | a+b��92.4 | C�� | 2p2��p3 | D�� | 2c1��c3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | AlCl3��NH3•H2O | B�� | NaOH��MgSO4 | C�� | Al2��SO4��3��NaOH | D�� | BaCl2��H2SO4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ʱ�䣨s�� | 0 | 1 | 2 | 3 | 4 | 5 |
| n��NO����mol�� | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com