
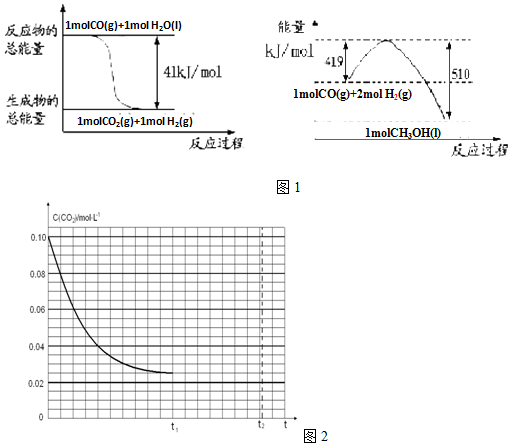
分析 (1)根据图1中能量变化写出反应的热化学方程式,然后根据盖斯定律写出由二氧化碳和氢气制备甲醇的热化学方程式;根据反应前后气体体积的变化判断△S;△G=△H-T•△S进行判断,如△G<0,则反应能自发进行,如△G>0,则不能自发进行;
(2)平衡常数只受温度的影响,该反应为放热反应,平衡常数增大,则平衡向着正向移动,说明降低了温度,据此进行解答;
(3)根据气体密度的变化计算出反应消耗的二氧化碳的物质的量,再计算出二氧化碳的平均反应速率;根据压强对反应速率的影响画出t1后c(CO2)随时间t变化趋势曲线.
解答 解:(1)图1中的热化学方程式为①CO(g)+H2O(l)=CO2(g)+H2(g)△H=-41kJ/mol,②CO(g)+2H2(g)=CH3OH(l)△H=-(510-419)kJ/mol=-91KJ/mol,依据盖斯定律②-①得:二氧化碳和氢气制备甲醇的热化学方程式:CO2(g)+3H2(g)=CH3OH(l)+H2O(l)△H=-50KJ/mol;该反应前后气体体积减小,则△S<0;△G=△H-T•△S<0时,反应能够自发进行,由于该反应为放热反应,△H<0,而△S<0,则温度降低时△G<0,该反应自发进行,
故答案为:CO2(g)+3H2(g)=CH3OH(l)+H2O(l)△H=-50KJ/mol;<;低温;
(2)如果反应方程式CO2+3H2?CH3OH+H2O的平衡常数K值变大,则需要降低温度,
A.降低温度,平衡一定向着正向移动,故A正确;
B.降低温度后,正逆反应速率都减小,正反应速率在达到平衡前始终在减小,故B错误;
C.平衡常数变大,反应物浓度减小,生成物浓度增大,则化学平衡一定向着正向移动,故C错误;
D.化学平衡常数变大,需要降低温度,则正逆反应速率都减小,由于平衡向着正向移动,则逆反应速率先减小后增大,故D正确;
故答案为:AD;
(3)若反应的容器容积为2.0L,反应时间4.0min,容器内气体的密度减小了2.0g/L,则气体减小的质量为:2.0g/L×2.0L=4.0g,
CO2(g)+3H2(g)=CH3OH(l)+H2O(l) 气体减少质量△m
1mol 50g
n 4.0g
反应消耗的二氧化碳的质量为:m=$\frac{1mol×4.0g}{50g}$=0.08mol,
在4min内C02的平均反应速率为:$\frac{\frac{0.08mol}{2L}}{4min}$=0.01mol.L-1;
保持其他条件不变,t1时将容器体积压缩到1L,t1时二氧化碳的浓度立刻增大为原先的2倍,即由0.025mol变为0.05mol,之后平衡向着正向移动,二氧化氮浓度减小,直至t2时达到新的平衡,t2时二氧化碳的浓度一定大于0.025mol,则t1后c(CO2)随时间t变化趋势曲线为: ,
,
故答案为:0.01mol.L-1.min-1;
点评 本题考查了热化学方程式的书写、化学反应速率的计算、化学平衡状态的判断等知识,题目难度较大,试题涉及的知识点较多,充分考查了学生对所学知识的掌握情况,试题有利于培养学生的分析、理解能力及化学计算能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 氢氧化物 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 |
| 沉淀完全的pH | 3.7 | 9.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
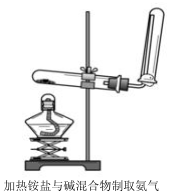 实验室一般采用如下装置制取氨气,按要求回答下列问题:
实验室一般采用如下装置制取氨气,按要求回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 通入氯气后的溶液中一定不存在I- | |
| B. | 通入氯气之后原溶液中的Fe2+全部被氧化 | |
| C. | 原溶液中的Br-不可能被氧化 | |
| D. | 若取少量所得溶液,再加入CCl4溶液充分振荡,静置、分液,下层溶液可能呈紫红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质 | 杂质 | 试剂 | 方法 | |
| A | 氯化铁溶液 | 氯化亚铁 | 过量铁粉 | 过滤 |
| B | 二氧化碳 | 二氧化硫 | 饱和NaHCO3溶液 | 洗气 |
| C | 二氧化硅 | 氧化铝 | 氨水 | 过滤 |
| D | 氯化钠溶液 | 碘化钠 | 四氯化碳 | 萃取 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{22.4nb}{m{N}_{A}}$ | B. | $\frac{22.4mb}{n{N}_{A}}$ | C. | $\frac{22.4n{N}_{A}}{mb}$ | D. | nbN$\frac{nb{N}_{A}}{22.4m}$ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com