
【题目】研究发现,NOx和SO2是雾霾的主要成分。
(一)NOx主要来源于汽车尾气。
已知:N2(g)+O2(g)![]() 2NO(g)△H=+180.50 kJ/mol
2NO(g)△H=+180.50 kJ/mol
2CO(g)+O2(g)![]() 2CO2(g)△H=-566.00kJ/mol
2CO2(g)△H=-566.00kJ/mol
(1)为了减轻大气污染,人们提出在汽车尾气排气管口采用催化剂将NO和CO转化成无污染气体参与大气循环。写出该反应的热化学方程式__________。
(2)T℃时,将等物质的量的NO和CO充入容积为2L的密闭容器中,保持温度和体积不变,反应过程(0-15min)中NO的物质的量随时间变化如图所示。

①T℃时该化学反应的平衡常数K= __________;若保持温度不变,再向容器中充入CO、N2各0.8mol,平衡将____________移动。(填“向左”、“向右”或“不”)
②图中a、b分别表示在一定温度下,使用质量相同但表面积不同的催化剂时,达到平衡过程中n(NO)的变化曲线,其中表示催化剂表面积较大的曲线是__________。(填“a”或“b”)
③15min时,若改变外界反应条件,导致n(NO)发生如图所示的变化,则改变的条件可能是________。
(二)SO2主要来源于煤的燃烧。燃煤烟气的脱硫减排是减少大气中含硫化合物污染的关键。
(3)用纯碱溶液吸收SO2可将其转化为HSO3-。该反应的离子方程式是_____________。
(4)如图电解装置可将雾霾中的NO、SO2分别转化为NH4+和SO42-。

①写出物质A的化学式_____________,阳极的电极反应式是_____________
②该电解反应的化学方程式为_______________________
【答案】
(1)2NO(g)+2CO(g)![]() 2CO2(g)+N2(g)△H=-746.50 kJmol-1;
2CO2(g)+N2(g)△H=-746.50 kJmol-1;
(2)①5(mol/L)-1;向右;②b;③增加CO的物质的量浓度或增大压强;
(3)H2O+2SO2+CO32-═2HSO3-+CO2↑;
(4)①H2SO4;SO2+2H2O-2 e-═SO42-+4H+;②5SO2+2NO+8H2O![]() (NH4)2SO4+4H2SO4。
(NH4)2SO4+4H2SO4。
【解析】
试题分析:(1)已知:N2(g)+O2(g)2NO(g)△H=+180.50kJmol-1①,2CO(g)+O2(g)CO2(g) △H=-566.00kJmol-1②,根据盖斯定律:②-①得到:2NO(g)+2CO(g)![]() 2CO2(g)+N2(g)△H=-746.50 kJmol-1;故答案为:2NO(g)+2CO(g)
2CO2(g)+N2(g)△H=-746.50 kJmol-1;故答案为:2NO(g)+2CO(g)![]() 2CO2(g)+N2(g)△H=-746.50 kJmol-1;
2CO2(g)+N2(g)△H=-746.50 kJmol-1;
(2)①起始时,NO为0.4mol,平衡时NO为0.2mol,
2NO(g)+2CO(g)![]() 2CO2(g) + N2
2CO2(g) + N2
起始物质的量:0.4mol 0.4mol 0 0
转化的物质量:0.2mol 0.2mol 0.2mol 0.1mol
平衡物质的量:0.2mol 0.2mol 0.2mol 0.1mol
则平衡时的浓度:c(NO)=0.1mol/L,c(CO)=0.1mol/L,c(CO2)=0.1mol/L,c(N2)=0.05mol/L,k=![]() =
=![]() =5(mol/L)-1;平衡时若保持温度不变,再向容器中充入CO、N2各0.8mol,则c(CO)=0.5mol/L,c(N2)=0.45mol/L,Qc=
=5(mol/L)-1;平衡时若保持温度不变,再向容器中充入CO、N2各0.8mol,则c(CO)=0.5mol/L,c(N2)=0.45mol/L,Qc=![]() =
=![]() =1.8<k,则平衡将向右移动;故答案为:5(mol/L)-1;向右;
=1.8<k,则平衡将向右移动;故答案为:5(mol/L)-1;向右;
②催化剂表面积较大,反应速率快,达到平衡所用时间短,由图可知,b曲线代表的条件下反应速率快,所以b的催化剂的表面积大;故答案为:b;
③由图象可知,NO的浓度减小,平衡向正方向移动,所以改变的条件为增加CO的物质的量浓度或增大压强;故答案为:增加CO的物质的量浓度或增大压强;
(3)碳酸钠溶液与
(4)电解装罝可将雾霾中的NO、SO2分别转化为NH4+和SO42-,则电解方程式为5SO2+2NO+8H2O![]() (NH4)2SO4+4H2SO4,
(NH4)2SO4+4H2SO4,
①由电解方程式可知,物质A为硫酸,其的化学式H2SO4; 电解时,阳极上二氧化硫失电子生成硫酸根离子,则阳极的电极反应式是SO2+2H2O-2 e-═SO42-+4H+;故答案为:H2SO4;SO2+2H2O-2 e-═SO42-+4H+;
②电解时NO、SO2分别转化为NH4+和SO42-,结合原子守恒可知电解方程式为:5SO2+2NO+8H2O![]() (NH4)2SO4+4H2SO4,故答案为:5SO2+2NO+8H2O
(NH4)2SO4+4H2SO4,故答案为:5SO2+2NO+8H2O![]() (NH4)2SO4+4H2SO4。
(NH4)2SO4+4H2SO4。


科目:高中化学 来源: 题型:
【题目】用下图所示实验装置进行相应实验,能达到实验目的的是

A.用图①所示装置,蒸干NH4Cl饱和溶液制备NH4Cl晶体
B.按装置②所示的气流方向可用于收集H2、NH3等
C.用图④所示装置,分离CCl4萃取I2水后的有机层和水层
D.用图④所示装置,可以证明氧化性Cl2>Br2>I2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知: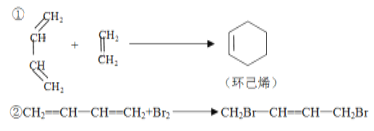
(1)写出下列反应产物的结构简式:
H2C=CHCH=CHCH3+H2C=CHCHO→ _______________。
(2)以某链烃A为起始原料合成化合物G 的路径如下(图中 Mr 表示相对分子质量)
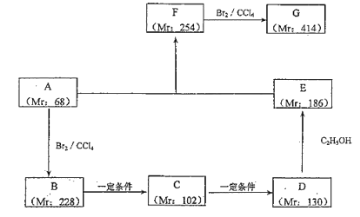
①写出反应类型 B→C:_______,F→G:_______。
②写出下列物质的结构简式:A:________,F:_______。
③写出下列反应的化学方程式:
B→C:________________;D→E:_______________。
④写出 G 与氢氧化钠溶液反应的方程式____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在反应中,X元素的原子将电子转移给Y元素的原子,则下列说法正确的是( ) ①元素X被氧化 ②元素Y被氧化 ③元素X发生还原反应 ④元素Y发生还原反应
A.①②
B.③④
C.②③
D.①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由2-氯丙烷为主要原料制取1,2-丙二醇,经过的反应为
A. 加成一消去-取代 B. 消去一加成一取代
C. 取代一消去一加成 D. 取代-加成-消去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向某碳酸钠和碳酸氢钠的混合溶液中逐滴加入稀盐酸,加入稀盐酸体积与标准状况下产生气体体积的关系如图所示。

(1)盐酸的物质的量浓度是多少_____。(要求写出简单过程)
(2)原溶液中碳酸钠与碳酸氢钠的物质的量之比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究或认识物质的化学性质一般可从以下几个方面入手(以SiO2为例):
(1)从物质类别角度分析可能具有的通性,如酸性、碱性等。
SiO2属于________氧化物(填“酸性”“碱性”或“两性”)。盛装NaOH等碱性溶液的试剂瓶不能用玻璃塞,其原因可用离子方程式表示为________。
(2)从核心元素化合价角度分析可能具有的氧化性、还原性。
据SiO2中Si元素的价态可推知SiO2________(填字母):
A.只有还原性 B.只有氧化性 C.既有还原性又有氧化性。
工业上用石英砂和焦炭混合高温制取含少量杂质的粗硅,写出该反应的化学方程式________。
(3)从其他角度认识可能具有的特性。
SiO2能与唯一的酸________(填物质名称)反应,工艺上常利用该反应________(填一种用途)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质均含有某种短周期常见元素,A、G为非金属单质,A常温下为黑色固体,G为空气的主要成份之一;D常温下为无色液体,C、E常温下均为气体,E是形成酸雨的元凶,相对分子质量是G的2倍;F常温下为淡黄色固体。它们的转化关系如图所示。

(1)写出化学式: B________ 、 F________。
(2)写出下列反应的化学方程式:
①:_____________________________________________________________;
②:_____________________________________,并用双线桥法标出反应②中的电子转移情况。
③:___________________________________________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com