
����Ŀ��I.AG����Ԫ���У���F��������Ϊ����������Ԫ�أ����ǵ�ԭ�ӽṹ���������±���ʾ��
Ԫ�� | ԭ�ӽṹ������ |
A | ���γɵ�һ��ͬλ��ԭ���ڿ����п��Ʋ⻯ʯ����� |
B | ��Aͬ���ڣ�������������ˮ��������Ũ��ϡ��Һ����ǿ������ |
C | �ؿ��к�������Ԫ�� |
D | Dԭ�ӵ�����������������Ӳ�����ͬ���ǵؿ��к�����Ľ���Ԫ�� |
E | �䵥����Ҫ�����ڻ�ɽ�ڸ��� |
F | �����г����Ľ���������ij����������д��� |
G | Gԭ����Dԭ��ͬ���ڣ���ԭ�Ӱ뾶��ͬ����Ԫ�������� |
��ش��������⣺
(1)A��Ԫ�����ڱ��е�λ����_______��F��ԭ�ӽṹʾ��ͼ��_____________��
(2)������ʵ��֤��C��E�ķǽ�����ǿ������_____��(�����)
�ٳ����£�C�ĵ��ʳ���̬��E�ĵ��ʳʹ�̬��C����̬�⻯����¶���ǿ��E����̬�⻯����¶��Ԣ�C��E�γɵĻ������У�E�����ۢ�E���⻯��ķе������C���⻯��ķе�
(3)��A��B��C����Ԫ������Ԫ�����γɵ�������������Ŀ֮��Ϊ1��1�����ӻ�������______(�ѧʽ)����������NaOH��Һ�ڼ���ʱ��Ӧ�����ӷ���ʽΪ��_______��
(4)A���⻯���ж��֣�1 molA��ij���⻯������к���14mol���ӣ���д�����⻯��ĵ���ʽ��______����֪��25�桢101kPa�£�1g���⻯����������������ȫȼ������Һ̬ˮʱ�ų�������Ϊ40kJ��д�����⻯��ȼ���ȣ�_________��
II.�ס��ҡ���������Ϊ����Ԫ�����γɵ����ʣ����ǵ��ʡ�����֮�������µķ�Ӧ��ϵ��

(1)����Ϊ����ɫ���壬�ڢ۷�Ӧ���õ�ͬһ��Һ̬�⻯������ʳ�����ʳƷ��ҵ����������ѧ����������________��д���ҡ����Ļ�ѧ����ʽ��__________��
(2)��������ʾ������ԣ��ڢ۷�Ӧ��Ҫ�Ï�����Һ���ܷ�Ӧ��ͨ������ġ�����������ЧӦ����Ҫ���塣д�������������ӷ���ʽ��__________�������£����ɶ������γɵ�ˮ��Һ�м�����Ũ��Ϊ1.3��10-6 mol��L-1�������Һ��pHΪ______��
(����KspΪ1.3��10-33)
���𰸡� �ʶ����ڵ�IVA�� ![]() �ڢ� NH4HCO3 NH4++HCO3-+2OH-
�ڢ� NH4HCO3 NH4++HCO3-+2OH-![]() CO32-+NH3��+2H2O
CO32-+NH3��+2H2O ![]() 1040 kJ��mol-1 ���Ӽ��빲�ۼ� 2Na2O2+2H2O=4NaOH+O2�� AlO2-+CO2+2H2O=Al(OH)3��+HCO3-��[Al(OH)4]-+CO2=Al(OH)3��+HCO3- 5
1040 kJ��mol-1 ���Ӽ��빲�ۼ� 2Na2O2+2H2O=4NaOH+O2�� AlO2-+CO2+2H2O=Al(OH)3��+HCO3-��[Al(OH)4]-+CO2=Al(OH)3��+HCO3- 5
��������I.���⿼��Ԫ�����ڱ���Ԫ�������ɵ�Ӧ�ã���1��A��һ��ͬλ�ؿ����Ʋ⻯ʯ�������AΪC��λ�ڵ�������IVA�壻F�����г����Ľ���������ij����������д��ԣ�����������Fe3O4����FΪFe��λ�ڵ�������VIIIA�壬��26��Ԫ�أ�ԭ�ӽṹʾ��ͼΪ![]() ����2���ٷǽ����Ե�ǿ���������ʵ�״̬�أ��ʢٴ��ڷǽ�����Խǿ�����⻯����ȶ���Խǿ�����C�ķǽ�����ǿ��E���ʢ���ȷ���۷ǽ����Ե�ǿ���õ�������ǿ�����ָ��ۣ����C�ķǽ�����ǿ��E���ʢ���ȷ���ܷǽ����Ե�ǿ�����۷е�ߵ��أ��ʢܴ���3��B��Cͬ���ڣ�B������������ˮ��������Ũ��ϡ��Һ����ǿ�����ԣ����BΪN��C�ǵؿ��к�������Ԫ�أ���CΪO������Ԫ������������ӣ������������ӻ�����������Ӹ�����Ϊ1��1������������NH4HCO3��������NaOH��Һ�ڼ���ʱ���������ӷ�Ӧ��NH4����HCO3����2OH��
����2���ٷǽ����Ե�ǿ���������ʵ�״̬�أ��ʢٴ��ڷǽ�����Խǿ�����⻯����ȶ���Խǿ�����C�ķǽ�����ǿ��E���ʢ���ȷ���۷ǽ����Ե�ǿ���õ�������ǿ�����ָ��ۣ����C�ķǽ�����ǿ��E���ʢ���ȷ���ܷǽ����Ե�ǿ�����۷е�ߵ��أ��ʢܴ���3��B��Cͬ���ڣ�B������������ˮ��������Ũ��ϡ��Һ����ǿ�����ԣ����BΪN��C�ǵؿ��к�������Ԫ�أ���CΪO������Ԫ������������ӣ������������ӻ�����������Ӹ�����Ϊ1��1������������NH4HCO3��������NaOH��Һ�ڼ���ʱ���������ӷ�Ӧ��NH4����HCO3����2OH��![]() NH3����CO32����2H2O����4����������������1mol���к���14mol���ӣ�һ��̼ԭ����6�����ӣ���˴���ΪC2H2�������ʽΪ
NH3����CO32����2H2O����4����������������1mol���к���14mol���ӣ�һ��̼ԭ����6�����ӣ���˴���ΪC2H2�������ʽΪ![]() ��ȼ������1mol��ȼ����ȫȼ�������ȶ������������ų������������1molC2H2��ȼ������40��26kJ��mol��1=1040kJ��mol��1��II.�������ƶϣ���1����Ϊ����ɫ���壬�����ɵ��ʼײ����������ΪNa2O2����ΪNa���ڢ���ͬһ��Һ̬�⻯�ﷴӦ������ˮ��Ӧ�����ΪNaOH�������ʳ�����ʳƷ��ҵ����˶�ΪNaHCO3��Na2O2�ĵ���ʽΪ��
��ȼ������1mol��ȼ����ȫȼ�������ȶ������������ų������������1molC2H2��ȼ������40��26kJ��mol��1=1040kJ��mol��1��II.�������ƶϣ���1����Ϊ����ɫ���壬�����ɵ��ʼײ����������ΪNa2O2����ΪNa���ڢ���ͬһ��Һ̬�⻯�ﷴӦ������ˮ��Ӧ�����ΪNaOH�������ʳ�����ʳƷ��ҵ����˶�ΪNaHCO3��Na2O2�ĵ���ʽΪ��![]() ���������Ӽ��ͷǼ��Թ��ۼ����ҡ����ķ�Ӧ����ʽΪ2Na2O2��2H2O=4NaOH��O2������2�������ʾ������ԣ��ҷ�Ӧ��ͨ�������һ����������ЧӦ�����壬������ΪCO2������ΪAl(OH)3����˼�ΪAl���ڢ۾�Ҫǿ����Һ�����ΪNaAlO2����Ϊ���Σ������������ӷ�Ӧ����ʽΪAlO2����CO2��2H2O=Al(OH)3����HCO3���������ܶȻ����м��㣬c(OH��)=
���������Ӽ��ͷǼ��Թ��ۼ����ҡ����ķ�Ӧ����ʽΪ2Na2O2��2H2O=4NaOH��O2������2�������ʾ������ԣ��ҷ�Ӧ��ͨ�������һ����������ЧӦ�����壬������ΪCO2������ΪAl(OH)3����˼�ΪAl���ڢ۾�Ҫǿ����Һ�����ΪNaAlO2����Ϊ���Σ������������ӷ�Ӧ����ʽΪAlO2����CO2��2H2O=Al(OH)3����HCO3���������ܶȻ����м��㣬c(OH��)= 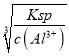 =
=![]() =10��9mol��L��1��c(H��)=Kw/c(OH��)=10��14/10��9mol��L��1=10��5mol��L��1����pH=5��
=10��9mol��L��1��c(H��)=Kw/c(OH��)=10��14/10��9mol��L��1=10��5mol��L��1����pH=5��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�����º��ݵ��ܱ������г���1 mol HI����������ƽ����2HI������![]() H2������+I2�����������HI��ת����Ϊa%�����ֺ��º��ݣ�������ƽ����ϵ���ٳ���2molHI������ƽ�⽨����HI��ת����Ϊb%,��a��b�Ĺ�ϵ��
H2������+I2�����������HI��ת����Ϊa%�����ֺ��º��ݣ�������ƽ����ϵ���ٳ���2molHI������ƽ�⽨����HI��ת����Ϊb%,��a��b�Ĺ�ϵ��
A��a��b B��a��b C��a��b D����ȷ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
�� 1 mol����һ�������·ֱ�������������������ȫ��Ӧת�Ƶ�������Ϊ2NA
��������Ϊ92��������Ϊ142����(U)ԭ�ӣ� ![]() U
U
��������Һ��ͨ�������� CO2��CO2 + H2O+ 2C6H5O-![]() 2C6H5OH + CO32-
2C6H5OH + CO32-
������ˮ�������c (OH-)=10-13 mol��L-1����Һ�У�Na+��Ba2+��Cl-��I-
�ݱ��мȴ��ڷ��»������ִ������
��1, 3-�������飺![]()
A. �ڢݢ� B. �ڢ� C. �ܢ� D. �٢ۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���¶��£��������ˮϡ��������Һ�ĵ���������ͼ��ʾ����ش�

(1)O��Ϊʲô������_________________��
(2)a��b��c������Һc��H+����С�����˳�� ��___________��
(3)a��b��c�����д���ĵ���̶������� _______�㡣
(4)��Ҫ��b����Һ��c��CH3COO-����c��OH-������С���ɲ��õķ�����___________��ѡ����ȷ��ѡ�
A.��ˮ B����NaOH C����H2SO4 D����Na2CO3
(5)��Ҫʹc����Һ�е�c(CH3COO��)��ߣ����Բ�ȡ���д�ʩ�е�________(����ĸ ���)��
A.���� B.��NaOH���� C.��ˮ D.�ӹ���CH3COONa
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ת���ڸ�����������ʵ�ֵ��ǣ� ��
��![]()
��![]()
��![]()
��![]()
��![]()
A. �٢ۢ� B. �ڢۢ� C. �ڢܢ� D. �٢ܢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڻ�ѧ�Ͼ���ʹ����˴Ź����ף����Ǹ��ݲ�ͬ��ѧ��������ԭ������˴Ź������и������źŲ�ͬ��ȷ���л�������еIJ�ͬ��ԭ�ӡ������л����������˴Ź�������ֻ����һ���źŵ���
A. CH3 O CH3 B. CH3 CH2OH C. HCOOH D. CH3COOCH3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
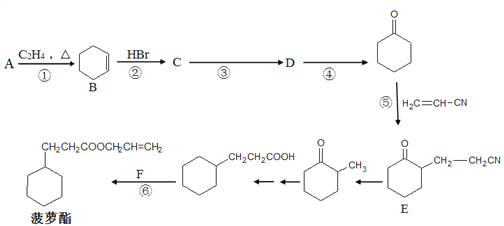
����Ŀ����������һ�ִ���Ũ���IJ�����������ζ��ʳ�����ϣ���ϳ�·������(���ַ�Ӧ��������������ȥ)��
��ش��������⣺
(1) A�������Ʊ�˳����˳ʽ��1��3-����ϩ����˳���Ľṹ��ʽΪ_________����˳����ƽ����Է�������Ϊ540108����ƽ���ۺ϶�Ϊ__________��
(2) F�Ľṹ��ʽΪ__________����Ӧ�ܵ�������________________��
(3) ��һ��Ӧ������ȡ����Ӧ����__________��
(4) �����й�B��˵����ȷ����__________(����ĸ���)��
a. Ԫ�ط����ǿ�ȷ��B��ʵ��ʽΪC6H10
b. �����ǿɼ��B������ʺɱȵ���ֵΪ82
c. ��������ǿɲⶨB������̼ԭ��һ����ͬһƽ����
d. �˴Ź����ǿɲⶨB������������ԭ�����շ�
(5) д����Ӧ�۵Ļ�ѧ����ʽ_________________��
(6) ͬʱ��������������E��ͬ���칹�����ĿΪ__________�֡�
�����Ȼ�����Һ����ɫ �ڱ�����ֻ��2��ȡ�����Ҵ��ڶ�λ
(7) ���������ϳ�·�ߣ��ֽ���AΪ�л�ԭ�ϣ����Լ���ѡ������Ʊ�![]() �ĺϳ�·�ߡ�
�ĺϳ�·�ߡ�
��֪���ٷ�Ӧ����ӵĻ���˫���Ȼ���˫�������ױ�������
��![]() ��R��R�������������⣩
��R��R�������������⣩
___________________________________________ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������һ�������һ�����ʵ���Ũ�ȵ���Һʱ�����в�����ʹ��õ���ҺŨ��ƫС����
A. ����ƿ��ԭ����������ˮ B. ��Һ���ձ�ת�Ƶ�����ƿ�к�û��ϴ���ձ�
C. ����ʱ����Һ�� D. �ιܼ�ˮʱ��������ˮ�ε�����ƿ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������أ�K2FeO4����һ�ּ�������������������һ������Ͷ��ˮ������������������ �ȶ��Բ�Ʊ�������ʪ�����ɷ����֣���ԭ�����±���ʾ��
ʪ���������������£�

�ش��������⣺
��1��K2FeO4 ��Fe�Ļ��ϼ� ��ʵ���Ҹɷ��Ʊ���ѡ�õ�������
A�������� B�������� C������������ D���մ�����
(2)���¶Ƚϸ�ʱKOH��Cl2��Ӧ���ɵ���KClO3��д�����¶Ƚϸ�ʱKOH��Cl2��Ӧ�Ļ�ѧ����ʽ
___________________��
��3������Һ I �м���KOH �����Ŀ����
A��ʹ KClO3 ת��Ϊ KClO
B��Ϊ��һ����Ӧ�ṩ���ԵĻ���
C��KOH �����ܽ���ȣ���������߷�Ӧ����
D������Һ I �й����� Cl2 ������Ӧ�����ɸ���� KClO
��4����������ǿ��Ũ��Һ�м��� 90%�� Fe��NO3��3��������Ӧ�����ӷ���ʽΪ��
�� Fe3��+3OH���TFe(OH)3���� ��
��5�����������������ˮϴ��ʪ��Ʒ������ϴȥ�����⣬���ŵ��� ��
��6������ж� K2FeO4 �����Ѿ�ϴ�Ӹɾ� ��
��7��������أ�K2FeO4����Ϊˮ���������ŵ�֮һ���ܳ�ȥ�������ʣ���ƽ�÷�Ӧ�����ӷ���ʽ��
____FeO42��+ H2O= Fe��OH��3�����壩+ O2��+ �� ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com