
分析 (1)铁离子的电子排布式为1s22s22p63s23p63d64s2,失去4s能级2个电子、3d能级1个电子形成Fe3+;
(2)金属性越强,第一电离能越小;
(3)K3[Fe(C2O4)3]中含有离子键、配位键、共价键;
(4)草酸(H2C2O4)的结构式为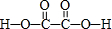 ,C原子没有孤对电子,杂化轨道数目为3,单键为σ键,双键含有1个σ键;
,C原子没有孤对电子,杂化轨道数目为3,单键为σ键,双键含有1个σ键;
(5)原子数目相等、价电子总数也相等的微粒互为等电子体,可以利用同主族替换法与周期表中元素左右移动书写.
解答 解:(1)铁离子的电子排布式为1s22s22p63s23p63d64s2,失去4s能级2个电子、3d能级1个电子形成Fe3+,铁离子核外电子排布式为:1s22s22p63s23p63d5,
故答案为:1s22s22p63s23p63d5;
(2)涉及的主族元素中,只有K为金属元素,其它均为非金属性,金属性越强,第一电离能越小,故K的第一电离能最小,
故答案为:K;
(3)K3[Fe(C2O4)3]中钾离子与配离子之间形成离子键,配离子中含有配位键、共价键,
故答案为:离子键、配位键、共价键;
(4)草酸(H2C2O4)的结构式为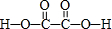 ,C原子没有孤对电子,杂化轨道数目为3,C原子采取sp2杂化,单键为σ键,双键含有1个σ键,分子中含有7个σ键,1mol草酸(H2C2O4)中含有σ键的数目为7mol,
,C原子没有孤对电子,杂化轨道数目为3,C原子采取sp2杂化,单键为σ键,双键含有1个σ键,分子中含有7个σ键,1mol草酸(H2C2O4)中含有σ键的数目为7mol,
故答案为:sp2杂化;7mol;
(5)原子数目相等、价电子总数也相等的微粒互为等电子体,与C2O42-互为等电子体的一种分子为N2O4,
故答案为:N2O4.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、电离能、化学键、配合物、杂化方式判断、等电子体等,难度不大,注意对基础知识的理解掌握.


 新思维寒假作业系列答案
新思维寒假作业系列答案科目:高中化学 来源: 题型:选择题
| A. | 0.2 mol/L 和0.1 mol/L的氨水中c(OH-)之比 | |
| B. | H2S溶液中c(H+)与c(S2-)之比 | |
| C. | Na2S溶液中c(Na+)与c(S2-)之比 | |
| D. | Na2O2晶体中阳离子与阴离子个数之比 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  将海带灼烧成灰 将海带灼烧成灰 | B. |  过滤得含I-的溶液 过滤得含I-的溶液 | ||
| C. |  向滤液中加稀H2SO4和H2O2溶液 向滤液中加稀H2SO4和H2O2溶液 | D. |  加入CCl4,萃取 加入CCl4,萃取 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:Si>Mg | B. | 氢元素不存在同位素 | ||
| C. | 该反应熵增 | D. | SiH4比HCl稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
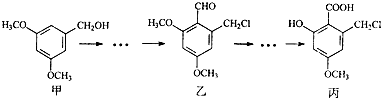
| A. | 甲、乙、丙三种有机化合物均可跟NaOH溶液反应 | |
| B. | 用FeCl3溶液区分甲、丙两种有机化合物 | |
| C. | 一定条件下丙可以与NaHCO3溶液、C2H5OH反应 | |
| D. | 乙、丙都能发生银镜反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
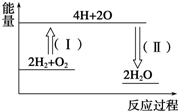 氢气燃烧生成液态水的热化学方程式为2H2(g)+O2(g)═2H2O(l)△H=-572kJ•mol-1,请回答下列问题:
氢气燃烧生成液态水的热化学方程式为2H2(g)+O2(g)═2H2O(l)△H=-572kJ•mol-1,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
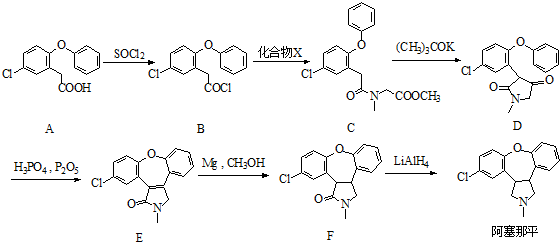
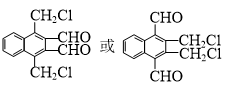 .
.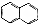 )的衍生物,且取代基都在同一个苯环上;
)的衍生物,且取代基都在同一个苯环上;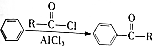 (R为烃基).根据已有知识并结合相关信息,写出以ClCH2CH2CH2Cl和
(R为烃基).根据已有知识并结合相关信息,写出以ClCH2CH2CH2Cl和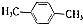 为原料制备
为原料制备 的合成路线流程图(无机试剂可任选).合成路线流程图示例如图所示:
的合成路线流程图(无机试剂可任选).合成路线流程图示例如图所示: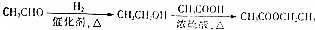
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
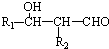
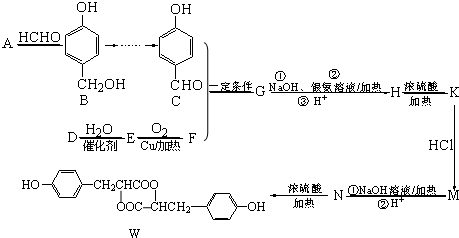
 .
.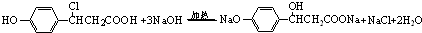 .
.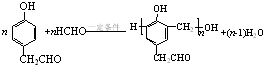 .
.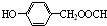 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | BaCl2、NaNO3、NH4Cl | B. | K2CO3、HCl、CaCl2 | ||
| C. | Na2CO3、HNO3、HCl | D. | K2CO3、KCl、H2SO4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com