
【题目】在指定条件下,下列各组离子一定能大量共存的是
A.滴加甲基橙显红色的溶液中:Na+、Fe2+、C1-、NO![]()
B.0.1mol·L-1FeC13溶液中:NH![]() 、Mg2+、SO
、Mg2+、SO![]() 、NO
、NO![]()
C.0.1mo1·L-1KI溶液中:Na+、K+、ClO-、OH-
D.由水电离的c(H+)=1.0×10-13 mo1·L-1的溶液中:K+、NH![]() 、C1-、HCO
、C1-、HCO![]()
 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案科目:高中化学 来源: 题型:
【题目】某同学为检验某溶液中是否含有常见的四种无机离子,进行了如图所示的实验操作.其中检验过程中产生的气体能使湿润的红色石蕊试纸变蓝.由该实验能得到的正确结论是![]()
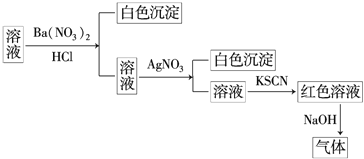
A.原溶液中一定含有![]() B.原溶液中一定含有
B.原溶液中一定含有![]()
C.原溶液中一定含有![]() D.原溶液中一定含有
D.原溶液中一定含有![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等质量的镁分别在足量的二氧化碳、氧气中燃烧,有关叙述正确的是( )
A.在二氧化碳中燃烧产生的固体质量大
B.在氧气中产生的氧化镁质量大
C.氧化剂与还原剂物质的量之比都是2∶1
D.反应中都是氧元素被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
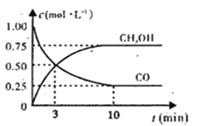
【题目】在工业上常用CO与H2合成甲醇,热化学方程式为CO(g)+2H2(g)![]() CH3OH(g) ΔH=-574.4 kJ·mol-1。
CH3OH(g) ΔH=-574.4 kJ·mol-1。
(1)下图是表示一定温度下,在体积为2L的密闭容器中加入5mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化情况。反应第10分钟达到平衡,从反应开始到平衡,用H2表示平均反应速率v(H2)=__mol/(L·min),且反应前后体系的压强之比为____。
(2)在一容积可变的密闭容器中充有10 mol CO和20 mol H2。CO的平衡转化率与温度(T)、压强(p)的关系如图所示。
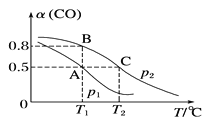
①A、B、C三点对应的平衡常数KA、KB、KC的大小关系为_____。
②若达到平衡状态A时,容器的体积为10 L,则在平衡状态B时容器的体积为__L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.由三种元素组成的化合物A,式量在200- -300之间。在一 定条件下A能发生如下图的转化,其中B的焰色反应为紫色(透过蓝色钴玻璃),C是不溶于酸的白色沉淀。

请回答∶
(1) C的化学式是______,组成A的三种元素是________。
(2) A加热分解的化学方程式是_____。
(3) E可以和SCl2反应生成一种常用于有机合成的物质SOCl2和另一种常见气体,反应的化学方程式是________。
II.实验室测定某铁铝合金中的铝含量,利用如图装置和试剂完成。

请回答∶
(1)下列有关该实验的说法中正确的是_______。
A.由于恒压分液漏斗的存在,该装置不能进行气密性检查
B.读数前需将量气管C上下移动使B、C中的液面相平
C.反应完成后生成的氢气都要转移至装置B中
D.需要控制NaOH的量以防止产生气体过多超过量气装置的量程
(2)若将恒压分液漏斗(A) 去掉导管a,改成普通分液漏斗,则测得铁铝合金中的铝含量______,(填“偏大”、“偏小”或“不变”),请说明理由_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应是在溶液中进行的反应,按下列要求作答:MnO2+4HCl(浓)![]() MnCl2+2H2O+Cl2↑
MnCl2+2H2O+Cl2↑
(1)用双线桥表示反应中电子的转移情况___;MnO2+4HCl(浓)![]() MnCl2+2H2O+Cl2↑
MnCl2+2H2O+Cl2↑
(2)该反应的氧化剂是___,发生了___反应。
(3)将其改写成离子方程式___。
(4)当有2molHCl消耗时,转移的电子的物质的量为___mol。
(5)浓盐酸在该反应中表现的性质是___(填序号)。
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将3 mol O2加入V L的反应器中,在高温下放电,经t1 s 建立了平衡体系:3O2![]() 2O3,此时测知O2的转化率为30%,下列图像能正确表示气体的物质的量(n)跟时间(t)的关系的是
2O3,此时测知O2的转化率为30%,下列图像能正确表示气体的物质的量(n)跟时间(t)的关系的是
A. B.
B. C.
C. D.
D.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二甲醚(CH3OCH3)是一种新型能源,被誉为“21世纪的清洁燃料”。
(1)用CO和H2合成二甲醚的反应为:3H2(g)+3CO(g)![]() CH3OCH3(g)+CO2(g)△H。
CH3OCH3(g)+CO2(g)△H。
几种物质的相对能量如下:
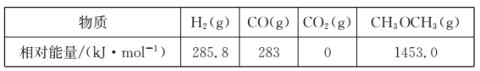
△H=______kJ·mo1。改变下列“量”,一定会引起△H发生变化的是_____(填代号)。
A.温度 B.反应物浓度 C.催化剂 D.化学计量数
(2)有利于提高反应中CH3OCH3产率的条件为_______(填标号)。
A.高温低压 B.低温高压 C.高温高压 D.低温低压
(3)采用新型催化剂(主要成分是Cu—Mn的合金)制备二甲醚。催化剂中n(Mn)/n(Cu)对合成二甲醚的影响情况如下图所示。
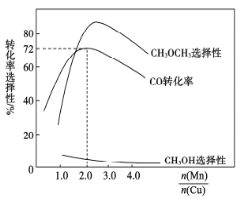
当n(Mn)/n(Cu)=2时,二甲醚的选择性(![]() )为85.8%,此时二甲醚的产率为_________。
)为85.8%,此时二甲醚的产率为_________。
(4)用二甲醚燃料电池电解法可将酸性含铬废水(主要含有Cr2O72-)转化为Cr3+。原理如下图:
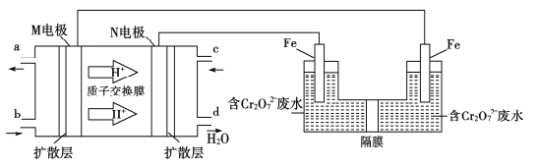
①燃料电池中的负极是______(填“M”或“N”)电极。电解池阴极的电极反应式为______________________________。
②消耗6.9g二甲醚时可处理Cr的含量为26.0g·L-1的废水1L,该套装置的能量利用率为___________。(保留3位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取氯气,将多余的氯气用100 mL 1.7mol/L的NaOH溶液完全吸收。对吸收后的溶液进行分析化验,测知c(OH-)=0.1mol/L (不考虑反应前后溶液的体积变化) 。ClO-和ClO3-的物质的量浓度之比为5∶1。请回答:
(1)吸收氯气消耗的NaOH的物质的量为_______________mol。
(2)被氧化的氯气的物质的量为_______________mol,被还原的氯气的物质的量为 _______________mol。
(3)若采用二氧化锰和浓盐酸共热的方法制氯气,制备尾气中的氯气所消耗的二氧化锰的质量为_______________g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com