
| ① | ② | ③ | ④ | |
| 溶液 | 氨水 | 氢氧化钠溶液 | 醋酸 | 盐酸 |
| pH | 11 | 11 | 3 | 3 |
| A. | V1L④与V2L②溶液混合后,若混合后溶液pH=4,则V1:V2=9:11 | |
| B. | 在①、②中分别加入适量的氯化铵晶体后,①的pH减小,②的pH不变 | |
| C. | 分别加水稀释10倍、四种溶液的pH:①>②>③>④ | |
| D. | 将①、④两种溶液等体积混合,所得溶液中:c (NH4+)>c(Cl-)>c(OH-)>c(H+) |
分析 A、根据酸碱反应的定量关系,结合溶液中氢离子物质的量和氢氧根离子物质的量和混合后的PH进行计算;
B、依据弱电解质的电离平衡影响因素分析判断;
C、依据溶液稀释过程中弱电解质存在电离平衡的移动进行分析判断;
D、依据酸碱反应和弱电解质的电离平衡分析比较.
解答 解:A、②中氢氧根离子浓度为10-3mol/L,④中氢离子浓度为10-3mol/L,混合反应后溶液pH=4,说明氢离子过量,混合溶液中的氢离子浓度为10-4mol/L,10-4mol/L=$\frac{n({H}^{+})-n(O{H}^{-})}{{V}_{1}+{V}_{2}}$=$\frac{{V}_{1}L×1{0}^{-3}mol/L-{V}_{2}×1{0}^{-3}mol/L}{{V}_{1}+{V}_{2}}$,整理得V1:V2=11:9,故A错误;
B、在①、②中分别加入适量的氯化铵晶体后,①中溶解形成的铵根对弱电解质的电离平衡起到了抑制作用,氢氧根离子浓度减小,pH减小;②中溶解的铵根离子与氢氧化钠溶液中的氢氧根离子会结合成弱电解质一水合氨,减小氢氧根离子的浓度,pH减小,故B错误;
C、①氨水pH=11,平衡状态下氢氧根离子浓度为10-3mol/L;②氢氧化钠pH=11,氢氧根离子浓度为10-3mol/L;③醋酸pH=3,平衡状态下氢离子浓度为10-3mol/L;④硫酸pH=3,溶液中氢离子浓度为10-3mol/L;分别加水稀释10倍、四种溶液的pH大小为,碱比酸的pH大,弱碱弱酸存在电离平衡,加水稀释比强酸强碱的pH变化小,所以得到①>②>④>③,故C错误;
D、将①氨水PH=11,平衡状态下氢氧根离子浓度为10-3mol/L④盐酸PH=3,溶液中氢离子浓度为10-3mol/L两种溶液等体积混合,生成氯化铵和一水合氨的混合物,以氨水电离为主,溶液呈碱性,综上所述可知溶液中的离子浓度大小c (NH4+)>c(Cl-)>c(OH-)>c(H+),故D正确;
故选D.
点评 本题考查了影响弱电解质的电离平衡的因素,酸碱混合时的定性分析和定量计算,pH的计算应用,溶液稀释时的pH变化判断,反应后溶液中的离子浓度大小判断,综合性较强.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{100w}{w+18a}$% | B. | $\frac{7100w}{161(w+18a)}$% | C. | $\frac{100w}{w+36a}$% | D. | $\frac{7100w}{161(w+36a)}$% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 凡有能量变化的过程都是化学变化 | |
| B. | 吸热反应只有在加热的条件下才能进行 | |
| C. | 放热反应可能需要在加热的条件下才能进行 | |
| D. | 化学反应中的能量变化都只以热能的形式表现出来 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 需加入的除杂试剂 | 发生反应的离子方程式 | |
| ①CO2气体中混有HCl杂质 | 饱和NaHCO3溶液 | H++HCO3-=H2O+CO2↑ |
| ②NaHCO3溶液中混有Na2CO3 | 足量CO2 | CO32-+H2O+CO2=HCO3- |
| ③FeCl2溶液中混有FeCl3杂质 | 铁粉 | Fe+2Fe3+=3Fe2+ |
| ④Fe2O3固体中混有Al2O3杂质 | NaOH溶液 | Al2O3+2OH-=AlO2-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
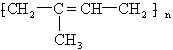 某有机化合物能在一定条件下发生加聚反应,生成高分子有机物,其结构简式如图,则合成该高聚物的单体是( )
某有机化合物能在一定条件下发生加聚反应,生成高分子有机物,其结构简式如图,则合成该高聚物的单体是( )| A. | 2-甲基-2-丁烯 | B. | 乙烯和丙烯 | ||
| C. | 1,3-T二烯 | D. | 2-甲基-1,3-丁二烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一氧化碳的转化率提高,水蒸气的转化率降低 | |
| B. | 反应物的转化率都提高 | |
| C. | 平衡向正反应方向移动,达到新的平衡时二氧化碳的体积分数增大 | |
| D. | 平衡向正反应方向移动,二氧化碳的物质的量将大于1 mol但小于2 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L1mol/L的碳酸钠溶液中含CO32-NA个 | |
| B. | 标准状况下,11.2L甲醇与足量钠反应,可生成标准状况下氢气5.6L | |
| C. | H2O2和H2O的混合物1mol中,含阴离子个数为NA | |
| D. | 标准状况下,22.4LCl2与足量铁充分反应,电子转移数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 在一定条件,可逆反应:mA+nB?pC达到平衡状态.
在一定条件,可逆反应:mA+nB?pC达到平衡状态.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com