
| 序号 | 消耗盐酸的体积/mL | 待测KOH溶液的体积/mL |
| 1 | 27.23 | 25.00 |
| 2 | 28.24 | 25.00 |
| 3 | 27.25 | 25.00 |
分析 (1)根据中和滴定有检漏、洗涤、润洗、装液、调零、取待测液加指示剂、滴定等操作过程;
(2)如溶液颜色变化且半分钟内不变色,可说明达到滴定终点;
(3)直接装入标准溶液,标准液的浓度偏低;
(4)根据c(待测)=$\frac{c(标注)×V(标准)}{V(待测)}$分析不当操作对V(标准)的影响,以此判断浓度的误差;同质量的氢氧化钠和氢氧化钾,氢氧化钠的物质的量大于氢氧化钾的物质的量,所以若称取含少量NaOH的KOH固体配制标准溶液,标准溶液中氢氧根离子的浓度偏大,根据c(待测)=$\frac{c(标注)×V(标准)}{V(待测)}$分析不当操作对V(标准)的影响;
(5)先根据数据的有效性,然后求出平均消耗V(盐酸),再根据反应HCl+KOH═KCl+H2O求出c(KOH).
解答 解:(1)操作的步骤是选择滴定管,然后洗涤、装液、使尖嘴充满溶液、固定在滴定台上,然后调节液面记下读数,再取待测液于锥形瓶,然后加入指示剂进行滴定,所以顺序为ACDEBF;
故答案为:ACDEBF;
(2)用0.1032mol•L-1的盐酸标准溶液滴定未知浓度的KOH溶液,用甲基橙作指示剂,所以终点时现象是当溶液由黄色变为橙色,且在半分钟内不褪色;
故答案为:当溶液由黄色变为橙色,且在半分钟内不褪色;
(3)滴定管用蒸馏水洗涤后,内壁有一层水膜,如果直接装液会使浓度降低,所以必须用标准溶液润洗滴定管2-3次;
故答案为:滴定管用蒸馏水洗涤后,内壁有一层水膜,如果直接装液会使浓度降低;
(4)锥形瓶用蒸馏水洗涤后,如果再用待测液润洗,会使锥形瓶内溶质的物质的量增大,会造成V(标准)偏大,根据c(待测)=$\frac{c(标注)×V(标准)}{V(待测)}$分析,测定结果偏高;同质量的氢氧化钠和氢氧化钾,氢氧化钠的物质的量大于氢氧化钾的物质的量,所以若称取KOH固体(含少量NaOH)配制标准溶液,标准溶液中氢氧根离子的浓度偏大,滴定时造成V(标)偏大,所测KOH浓度偏大;
故答案为:偏高;偏高;因为同质量的NaOH比KOH中和能力强,消耗的盐酸多;
(5)三次滴定消耗盐酸的体积为:27.23mL,28.24mL,27.25mL,第2组数据无效,则平均消耗V(盐酸)=27.24mL,
HCl+KOH═KCl+H2O
27.24mL×0.1032mol/L 25.00ml×c(KOH)
解得:c(KOH)=0.1124mol/L;
故答案为:0.1124.
点评 本题考查了酸碱中和滴定、化学计算及误差分析,题目难度中等,旨在考查学生灵活运用基础知识解决实际问题的能力,有利于培养学生规范的实验设计能力.


 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案科目:高中化学 来源:2016-2017学年西藏拉萨中学高二上第一次月考化学试卷(解析版) 题型:选择题
下列热化学方程式中ΔH代表燃烧热(25℃,101 kPa)的是
A.CH4(g)+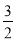 O2(g)
O2(g)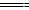 2H2O(l)+CO(g)ΔH1
2H2O(l)+CO(g)ΔH1
B.2CO(g)+O2(g)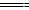 2CO2(g)ΔH2
2CO2(g)ΔH2
C.S(s)+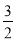 O2(g)
O2(g)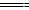 SO3(s)ΔH3
SO3(s)ΔH3
D.C6H12O6(s)+6O2(g)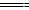 6CO2(g)+6H2O(l)ΔH4
6CO2(g)+6H2O(l)ΔH4
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 称量0.40g NaOH固体,在烧杯中加入100mL 水溶解即可 | |
| B. | 将称量好的固体NaOH放入100 mL容量瓶中,加蒸馏水溶解至环形刻线 | |
| C. | 定容时如果加水超过了刻度线,用胶头滴管直接吸出多余部分 | |
| D. | 将烧杯中溶解固体NaOH所得溶液冷却到室温后,转移至容量瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | V1>V2 | B. | V1<V2 | C. | V1=V2 | D. | V1≤V2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| HX | HY | HZ | |
| 浓度 mol•L-1 | 0.1 0.5 | 1.0 1.5 | 2.0 2.5 |
| 电离度 | 0.3% 0.13% | 0.3% 0.24% | 0.5% 0.45% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
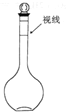 欲配制100ml 1.0mol/L Na2SO4溶液,下列说法正确的是( )
欲配制100ml 1.0mol/L Na2SO4溶液,下列说法正确的是( )| A. | ②④ | B. | ②③ | C. | ①③ | D. | 以上都不对 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com