
| A、用托盘天平称取11.7g食盐 |
| B、用量筒量取12.36ml盐酸 |
| C、用酸式滴定管量取21.20ml 0.10mol/L H2SO4溶液 |
| D、用200ml容量瓶配制500ml 0.1mol/L NaCl溶液 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 混合物 | 试剂 | 分离方法 | |
| A | 苯(苯酚) | 溴水 | 过滤 |
| B | 淀粉(氯化钠) | 蒸馏水 | 渗析 |
| C | 乙酸乙酯(乙酸) | NaOH溶液 | 蒸馏 |
| D | 乙烷(乙烯) | 氢气 | 加热 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| Fe |
| HCl |

 的所有原子
的所有原子查看答案和解析>>
科目:高中化学 来源: 题型:
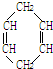 可简写为
可简写为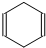 .现有某化合物W的分子结构可表示为
.现有某化合物W的分子结构可表示为 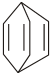 .
.查看答案和解析>>
科目:高中化学 来源: 题型:
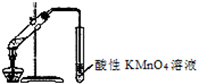 下列实验操作或实验方案设计正确的有.( )
下列实验操作或实验方案设计正确的有.( )| A、②④⑤ | B、①③⑥ |
| C、①③ | D、②④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将废弃物混在垃圾中填埋在土壤中 |
| B、将废弃物焚烧 |
| C、将废弃物用化学方法加工成涂料或汽油 |
| D、将废弃物倾倒在海洋中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
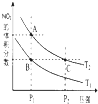 氮是地球上含量丰富的一种元素,氮元素的单质及其化合物在工农业生产、生活中有着重要作用.
氮是地球上含量丰富的一种元素,氮元素的单质及其化合物在工农业生产、生活中有着重要作用.| 7 |
| 8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com