
为了使宇航员在飞船中得到一个稳定的、良好的生存环境,一般在飞船内安装盛有Na2O2或K2O2颗粒的装置,它的用途是产生氧气。下列关于Na2O2的叙述正确的是
①Na2O2中阴、阳离子的个数比是1:1
②Na2O2分别与水及CO2反应产生等量氧气时,需水和CO2的质量相等
③Na2O2分别与水及CO2反应产等量氧气时,转移电子的物质的量相等
④Na2O2的漂白原理与SO2的漂白原理相同
⑤Na2O2与SO2反应生成Na2SO3与H2O
⑥Na2O2能与酸反应生成盐和水,所以Na2O2是碱性氧化物
⑦Na2O2与水反应,Na2O2既是氧化剂,又是还原剂
⑧Na2O2投入到紫色石蕊试液中,溶液先变蓝,后褪色
A.①③⑥⑧ B.③⑦⑧ C②⑤⑥⑦ D.①④⑧
【知识点】过氧化钠的结构和性质C1 B2 B3
【答案解析】B 解析:①Na2O2中阴、阳离子的个数比是1:2,错误;
②Na2O2分别与水及CO2反应产生等量氧气时,需水和CO2的质量不相等,错误;
③Na2O2分别与水及CO2反应产1摩尔氧气时,转移电子的物质的量都是2摩尔,正确;
④Na2O2的漂白原理是利用其强氧化性,SO2的漂白原理是与有色物质结合成无色物质,漂白原理不相同,错误;
⑤Na2O2与SO2反应,Na2SO3容易被氧化,最终得到Na2SO4,错误;
⑥Na2O2能与酸反应生成盐和水还有氧气,所以Na2O2不是碱性氧化物,错误;
⑦Na2O2与水反应,氧元素的化合价有升有降,Na2O2既是氧化剂,又是还原剂,正确;
⑧Na2O2投入到紫色石蕊试液中,由于有碱生成,溶液先变蓝,强氧化性又能使其褪色,正确;
故答案选B
【思路点拨】本题考查了过氧化钠的结构和性质,要从氧化还原的角度进行分析。


 培优三好生系列答案
培优三好生系列答案科目:高中化学 来源: 题型:
结构简式为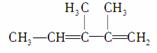 的化合物正确的命名是( )
的化合物正确的命名是( )
A.3,4二甲基2,3戊二烯 B.2,3二甲基2,4戊二烯
C.2,3二甲基1,3戊二烯 D.2,3二甲基2,3戊二烯
查看答案和解析>>
科目:高中化学 来源: 题型:
汽车剧烈碰撞时,安全气囊中发生反应10NaN3+2KNO3 = K2O+5Na2O+16N2↑,对于该反应,下列判断正确的是
A. NaN3中氮元素的化合价为-3
B.氧化剂和还原剂是同一物质
C.反应过程中若转移1mol电子,则产生2.24L气体(标准状况)
D.被氧化的氮原子与生成的氮气分子个数之比为15:8
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关实验操作、现象和解释或结论都正确的是
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 过量的Fe粉中加入稀HNO3,充分反应后,滴入KSCN溶液 | 溶液呈红色 | 稀HNO3将Fe氧化为Fe3+ |
| B | AgI沉淀中滴入稀KCl溶液 | 有白色沉淀出现 | AgCl比AgI更难溶 |
| C | Al箔插入稀HNO3中 | 无现象 | Al箔表面被HNO3氧化,形成致密的氧化膜 |
| D | 用玻璃棒蘸取浓氨水点到红色石蕊试纸上 | 试纸变蓝色 | 浓氨水呈碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
某强酸性溶液X中仅含有Ba2+、Al3+、NH4+、Fe2+、Fe3+、CO32-、SO32-、SO42-、Cl-、NO3-中的一种或几种,取该溶液进行连续实验,实验过程如下:
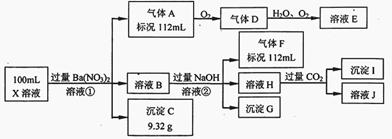
根据以上信息,回答下列问题:
(1)仅根据上述连续实验不能确定溶液X中是否含有的阳、阴离子分别是_____________。
若要用实验证明该阴离子是否存在,最可靠的化学方法是_____________。
(2)尽量用离子方程表达下列反应:
①中生成气体A:_____________。
②中生成溶液H:_____________。
③中产生的气体F遇氯气产生白烟:_____________。
(3)若②中所用氢氧化钠浓度为2mol/L,当加入l0 ml时开始产生沉淀,55 ml时沉淀的量达到最大值0.03 mol,继续滴加沉淀的量保持不变,随后再滴加沉淀部分溶解,到60ml时沉淀的量降为0.025 mol且保持不变,则原溶液中c(Fe2+)为___________mol/L、c(Fe3+)为___________mol/L、c(Cl-)为___________mol/L。(若有些离子不存在,请填0 mol/L)
查看答案和解析>>
科目:高中化学 来源: 题型:
.硫酸亚铁铵[(NH4)2Fe(SO4)2·6H2O]较硫酸亚铁不易被氧气氧化,是分析化学中重要的试剂,常用于代替硫酸亚铁。硫酸亚铁铵在 500℃时隔绝空气加热完全分解。回答下列问题:
(1)硫酸亚铁铵隔绝空气加热完全分解,发生了氧化还原反应,固体产物可能有FeO和Fe2O3,气体产物可能有NH3、SO3、H2O、N2和 。
(2)为检验分解产物的成份,设计如下实验装置进行实验,加热A中的硫酸亚铁铵至分解完全。
① A中固体充分加热较长时间后,通入氮气,目的是 。
②为验证A中残留物是否含有FeO,需要选用的试剂有 。
A.KSCN溶液 B.稀硫酸
C.浓盐酸 D.KMnO4溶液
③装置B中BaCl2溶液的作用是为了检验分解产物中是否有 气体生成,若含有该气体,观察到的现象为 。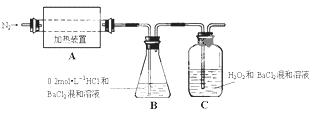
④若A中分解产物有N2,固体残留物只有Fe2O3,Fe2O3的物质的量为bmol,C中沉淀物质的量为amol,则b a(填“大于”、“小于”或“等于”)
⑤实验中,观察到C中有白色沉淀生成,则C中发生的反应为
(用离子方程式表示)。
(3)已知亚铁离子被氧气氧化的反应是:4Fe2+ + O2 + (4+2x) H2O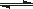 2Fe2O3•xH2O + 8H+,硫酸亚铁铵溶液较硫酸亚铁溶液不易被氧气氧化,其原因是 。
2Fe2O3•xH2O + 8H+,硫酸亚铁铵溶液较硫酸亚铁溶液不易被氧气氧化,其原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
常见元素A、B、M组成的四种物质发生反应:甲+乙 丙+丁,其中甲由A和M组成,乙由B和M组成,丙只含M。
(1)若甲为淡黄色固体,乙和丙均为常温下的无色无味气体。则甲的电子式为 ;生成标准状况下5.6L丙转移移电子数为 ;常温下丁溶液pH 7,用离子方程式解释 。
(2)若丁为能使品红褪色的无色气体,丙为常见紫红色金属,化合物甲、乙中原子个数比均为1:2(M均显+1价),原子序数B大于A。则:
①A在周期表中位置为
②将丁通至FeCl3溶液中的现象为
离子反应方程式为
③正确书写上述生成丙的化学方程式
④向MCl2的溶液中通入丁,可观察到白色的MC1沉淀,写出该反应的离子方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D、E是元素周期表中五种短周期元素,原子序数依次增大。 A、B、C、D位于同一周期。已知A原子核外有3个能级,且每个能级上的容纳的电子数目相同。C与E同主族,且C的单质为空气中的主要成份。X元素的原子核外有26个运动状态完全不相同的电子。回答下列问题:
(1)C、D、E中第一电离能最大的是 (填元素符号),X的价电子排布式为
。
(2)B的气态氢化物分子呈 形。该分子的中心原子的杂化方式为 。
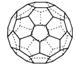 (3)A的一种单质相对分子质量为720,分子构型为一个32面体,
(3)A的一种单质相对分子质量为720,分子构型为一个32面体,
|
种单质中π键的数目为 。
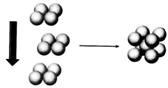 (4)X元素对应的单质在形成晶体时,采用如图2所示
(4)X元素对应的单质在形成晶体时,采用如图2所示
的堆积方式。则这种堆积模型的配位数为 ,
如果X的原子半径为a cm,阿伏加德常数的值为
NA,则计算此单质的密度表达式为 g/cm3
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com