
分析 (1)海带中碘以离子形式存在,烧、溶解、过滤后,需要加氧化剂转化为碘单质,再萃取碘;
(2)灼烧海带时在坩埚中进行;
(3)“过滤”后溶液中含一定量硫酸盐和碳酸盐.现要检验溶液中的I-,显加硝酸钡排除硫酸盐和碳酸盐的干扰,再利用硝酸银检验碘离子;
(4)检验含I2溶液中是否含有IO3-,萃取后,利用水层是否具有氧化性来说明;
(5)分解水可用SO2/I2循环法,先发生氧化还原反应生成硫酸、HI,再发生硫酸的分解、HI的分解反应,从而避免电解水的能源消耗,但有二氧化硫的排放.
解答 解:(1)海带中碘以离子形式存在,烧、溶解、过滤后,需要加氧化剂转化为碘单质,再萃取碘,则步骤为灼烧、溶解、过滤、氧化、萃取(或萃取分液) 及蒸馏,
故答案为:氧化;萃取(或萃取分液);
(2)灼烧海带时在坩埚中进行,则需要的仪器为三脚架、酒精灯、玻璃棒、坩埚(或瓷坩埚)、泥三角,故答案为:坩埚(或瓷坩埚)、泥三角;
(3)“过滤”后溶液中含一定量硫酸盐和碳酸盐.现要检验溶液中的I-,显加硝酸钡排除硫酸盐和碳酸盐的干扰,再利用硝酸银检验碘离子,则需选择的试剂组合及其先后顺序是ba,故答案为:ba;
(4)检验含I2溶液中是否含有IO3-,步骤为①取适量含I2溶液用CCl4多次萃取、分液,直到水层用淀粉溶液检验不出有碘单质存在;②从水层取少量溶液,加入1~2 mL淀粉溶液,加盐酸酸化,滴加Na2SO3溶液,若溶液变蓝,说明滤液中含有IO3-,若溶液不变蓝,说明滤液中不含有IO3-,
故答案为:从水层取少量溶液,加入1~2 mL淀粉溶液,加盐酸酸化,滴加Na2SO3溶液,若溶液变蓝,说明滤液中含有IO3-,若溶液不变蓝,说明滤液中不含有IO3-;
(5)分解水可用SO2/I2循环法,先发生氧化还原反应生成硫酸、HI,再发生硫酸的分解、HI的分解反应,涉及的反应为SO2+I2+2H2O=2HI+H2SO4、2H2SO4 $\frac{\underline{\;\;△\;\;}}{\;}$2SO2↑+O2↑+2H2O、2HI$\frac{\underline{\;\;△\;\;}}{\;}$H2+I2,与传统的分解水的方法相比,本法的优点是节约电能;缺点是使用能造成污染环境的SO2,
故答案为:SO2+I2+2H2O=2HI+H2SO4;2HI$\frac{\underline{\;\;△\;\;}}{\;}$H2+I2;节约电能;使用能造成污染环境的SO2.
点评 本题考查海水资源利用及分离提纯实验方案的设计,为高频考点,把握氧化还原反应原理、离子检验及实验技能为解答的关键,侧重分析与实验能力的考查,题目难度中等.


 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案科目:高中化学 来源: 题型:解答题
| 实验步骤 | 预期现象和结论 | |
| 步骤1 | 将上述澄清溶液分置于A、B试管中. | |
| 步骤2 | ||
| 步骤3 | ||
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-) | |
| B. | 2c(Na+)=c(HCO3-)+2c(CO32-)+c(H2CO3) | |
| C. | c(K+)>c(Na+)>c(HCO3-)+c(CO32-)>c(OH-)>c(H+) | |
| D. | c(OH-)+c(CO32-)=c(H+)+c(H2CO3)+0.1 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 嘴嚼米饭时有甜味(化学变化) | |
| B. | 玻璃窗破裂(化学变化) | |
| C. | 二氧化碳使澄清的石灰水变浑浊(物理变化) | |
| D. | 纯净物加热后变为混合物(物理变化) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
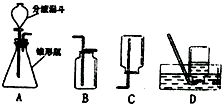 过氧化氢溶液在二氧化锰作催化剂的条件下能迅速分解,分液漏斗可以通过调节活塞控制液体的滴加速度,请根据图回答以下问题:
过氧化氢溶液在二氧化锰作催化剂的条件下能迅速分解,分液漏斗可以通过调节活塞控制液体的滴加速度,请根据图回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(NH3)=0.2 mol•L-1•s-1 | B. | v(N2)=1.0 mol•L-1•min-1 | ||
| C. | v(H2)=1.67 mol•L-1•min-1 | D. | v(H2)=0.3 mol•L-1•min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能够提高化学反应速率 | B. | 能够提高产品的产量 | ||
| C. | 能够提高经济效益 | D. | 能够节约原料和能源 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com