
某羧酸酯的分子式为C57H104O6,1 mol该酯完全水解可得到3 mol羧酸M和1 mol甘油[HOCH2CH(OH)CH2OH]。羧酸M的分子式为( )
A.C17H32O2 B.C18H34O2 C.C18H36O2 D.C19H36O2
 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | C、N、P | B. | N、P、O | C. | N、O、S | D. | C、Si、P |
查看答案和解析>>
科目:高中化学 来源:2017届安徽省黄山市高三上月考二化学卷(解析版) 题型:推断题
【化学—选修5:有机化学基础】
盐酸普鲁卡因(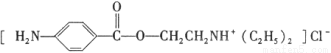 )是一种局部麻醉剂,麻醉作用较快、较强,毒性较低,其合成路线如下:
)是一种局部麻醉剂,麻醉作用较快、较强,毒性较低,其合成路线如下:
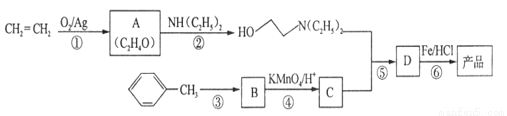
已知:①
②
③
请回答以下问题:
(1)A的核磁共振氢谱只有一个峰,则A的结构简式为 。
(2)C的结构简式为 ,C中含有的含氧官能团的名称为 。
(3)合成路线中属于氧化反应的有 (填序号),反应③的反应类型为 。
(4)反应⑤的化学反应方程式为 。
(5)B的某种同系物E,相对分子质量比B大14,其中—NO2与苯环直接相连,分子的核磁共振氢谱有3个峰,则E的结构简式为 (写一种)。
(6)符合下列条件的E的同分异构体的数目有 种。
① 结构中含有一个“—NH2”与一个“—COOH”
② 苯环上有三个各不相同的取代基
(7)苯丙氨酸(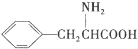 )是人体必需的氨基酸之一,写出其发生缩聚反应的化学方程式 。
)是人体必需的氨基酸之一,写出其发生缩聚反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源:2017届安徽省黄山市高三上月考二化学卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的值,下列叙述正确的是( )
A.常温常压下,22.4 L乙烯中C—H键数为4 NA
B.1 mol羟基中电子数为10 NA
C.在反应KIO3 + 6 HI = KI + 3 I2 + 3 H2O中,每生成3 mol I2转移的电子数为6 NA
D.常温下,1 L 0.1 mol·L-1 的NH4NO3溶液中氮原子数为0.2 NA
查看答案和解析>>
科目:高中化学 来源:2017届重庆一中高三上学期第二次月考化学试卷(解析版) 题型:选择题
下列实验操作、现象及由此得出的结论均正确的是
选项 | 实验操作 | 现象 | 结论 |
A | 将铜粉加入1.0 mol·L-1Fe2(SO4)3溶液中 | 铜粉溶解 | 金属铜比铁活泼 |
B | 将pH试纸放在玻片上,用玻璃棒蘸取某新制氯水,点在pH试纸中央,与标准比色卡对照 | pH=2 | 氯气与水反应生成了强酸 |
C | 向含有Fe2+的MgSO4溶液中,先加H2O2溶液,然后再调溶液的pH约为5 | 有红褐色沉淀生成 | Fe2+被H2O2氧化为Fe3+ |
D | 将KI和FeCl3溶液在试管中混合后,加入汽油,振荡,静置 | 下层溶液显紫红色 | 生成的I2全部溶于汽油中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学式 | H2(g) | CO(g) | CH3OH(l) |
| 标准燃烧热(25℃) △H/kJ•mol-1 | -285.8 | -283.0 | -726.5 |
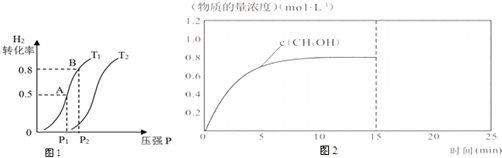
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
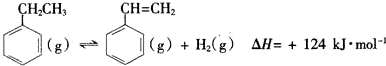
| 化学键 | C-H | C-C | C=C | H-H |
| 键能/kJ•mol-1 | 412 | 348 | x | 436 |
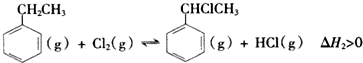
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为防止电池中的重金属污染土壤和水体,应积极开发废旧电池的综合回收利用 | |
| B. | 氢能是清洁能源,工业上电解水法制大量氢气符合节能减排理念 | |
| C. | 大量的汽车尾气是造成雾霾天气的一个重要因素 | |
| D. | 煤的液化和气化均属于化学变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 +3HNO3 $→_{△}^{浓硫酸}$
+3HNO3 $→_{△}^{浓硫酸}$ +3H2O;
+3H2O; 查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com